Саксенда раствор для инъекций 6 мг/мл 3 мл картридж в шприц-ручке №3, Novo Nordisk
- Наличными при получении
- Картой на сайте
Сеть аптек «Бажаємо здоров'я» сотрудничает только с проверенными поставщиками. Препараты, поступающие в наши аптеки, проходят все соответствующие этапы реализации лекарственных средств. Больше информации.
Лекарственные препараты и средства, предметы сангигиены и изделия медицинского назначения надлежащего качества, отпущенные из аптек и структурных подразделений, возврату не подлежат. Больше информации.
Особенности применения
діюча речовина: ліраглутид;
1 мл розчину містить 6 мг ліраглутиду – аналога людського глюкагоноподібного пептиду-1 (ГПП-1), виготовленого за технологією рекомбінантної ДНК в Saccharomyces cerevisiae;
одна попередньо заповнена шприц-ручка містить 18 мг ліраглутиду в 3 мл;
допоміжні речовини: натрію гідрофосфат, дигідрат; пропіленгліколь; фенол; кислота хлористоводнева (для корекції рН); натрію гідроксид (для корекції рН); вода для ін’єкцій.
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий та безбарвний або майже безбарвний ізотонічний розчин; рН=8,15.
Препарати, що застосовуються при цукровому діабеті, аналоги глюкагоноподібного пептиду-1 (ГПП-1). Код ATХ A10B J02.
Фармакодинаміка.
Ліраглутид є ацильованим аналогом ГПП-1 з послідовністю амінокислот на 97 % гомологічною ендогенному людському ГПП-1. Ліраглутид зв’язується з ГПП-1-рецепторами та активує їх.
ГПП-1 є фізіологічним регулятором апетиту та споживання їжі, але точний механізм його дії повністю не встановлений. У дослідженнях на тваринах периферійне введення ліраглутиду призвело до його накопичення в специфічних ділянках мозку, що відповідають за регуляцію апетиту, де ліраглутид завдяки специфічній активації рецепторів ГПП-1 підвищував відчуття насичення і знижував сигнали голоду, що сприяло зниженню маси тіла.
Рецептори ГПП-1 також експресуються у певних ділянках серця, судин, імунній системі та нирках. При моделюванні атеросклерозу у мишей ліраглутид запобігав прогресуванню аортальної атеросклеротичної бляшки та знижував запалення в бляшці. Крім того, ліраглутид позитивно впливав на ліпіди плазми. Ліраглутид не зменшував розмір вже наявних атеросклеротичних бляшок.
Фармакодинамічні ефекти
Ліраглутид знижує масу тіла у людей головним чином за рахунок втрати жирової маси, при цьому завдяки зменшенню переважно вісцерального жиру порівняно з підшкірним. Ліраглутид регулює апетит, підсилюючи відчуття ситості та наповненості шлунка, знижуючи при цьому відчуття голоду, та призводить до зниження споживання їжі. Ліраглутид не збільшує енерговитрати порівняно з плацебо.
Ліраглутид стимулює секрецію інсуліну та зменшує надмірно високу секрецію глюкагону залежно від рівня глюкози, що призводить до зниження глюкози натще та після вживання їжі.
У пацієнтів з переддіабетом та цукровим діабетом ефект зниження рівня глюкози більш виражений, порівняно з пацієнтами з нормоглікемією. Клінічні випробування свідчать, що ліраглутид покращує та підтримує функцію бета-клітин відповідно до НОМА-В та співвідношення проінсулін/інсулін.
Клінічна ефективність та безпека
Клінічна ефективність та безпека ліраглутиду при застосуванні для зниження маси тіла як доповнення до дієти зі зниженою калорійністю та збільшеною фізичною активністю були вивчені у чотирьох рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях фази 3 за участі 5358 пацієнтів.
Дослідження 1 (SCALE Ожиріння та переддіабет – 1839):
Всього 3731 пацієнт із ожирінням (індекс маси тіла (ІМТ) ≥30 кг/м2) або з надмірною масою тіла (ІМТ ≥27 кг/м2) і дисліпідемією та/або артеріальною гіпертензією були стратифіковані за допомогою скринінгу відповідно до статусу переддіабету та початкового рівня ІМТ (≥ 30 кг/м2 або <30 кг/м2). Всі пацієнти (3731) були рандомізовані на лікування протягом 56 тижнів, а 2254 пацієнти, які мали переддіабет на момент скринінгу, були рандомізовані на лікування протягом 160 тижнів. Обидва періоди лікування супроводжувались 12-тижневим періодом спостереження за групами препарат/плацебо. Корекція способу життя у вигляді дієти зі зниженою калорійністю та збільшеною фізичною активністю була базовою терапією для всіх пацієнтів.
У 56-тижневому дослідженні 1 оцінювали зниження маси тіла у всіх (3731) рандомізованих пацієнтів (2590 пацієнтів завершили курс лікування).
У 160-тижневому дослідженні 1 оцінювали час до розвитку цукрового діабету 2 типу у 2254 рандомізованих пацієнтів з переддіабетом (1128 пацієнтів завершили курс лікування).
Дослідження 2 (SCALE Діабет – 1922):
Дослідження тривалістю 56 тижнів, у якому оцінювали зниження маси тіла у 846 рандомізованих пацієнтів із ожирінням та надмірною масою тіла (628 пацієнтів завершили курс лікування), які мали недостатньо контрольований цукровий діабет 2 типу (HbA1c в діапазоні 7–10 %). Основним методом лікування на початку дослідження була або дієта, або збільшена фізична активність, або застосування окремих лікарських засобів, таких як метформін, сульфонілсечовина та глітазон, або їх комбінацій.
Дослідження 3 (SCALE Апное під час сну – 3970):
Дослідження тривалістю 32 тижні, в якому оцінювали ступінь тяжкості апное під час сну та зниження маси тіла у 359 рандомізованих пацієнтів (276 пацієнтів завершили курс лікування) з ожирінням та обструктивним апное під час сну середнього або тяжкого ступеня.
Дослідження 4 (SCALE Підтримуюче лікування - 1923):
У дослідженні тривалістю 56 тижнів оцінювали підтримуюче лікування після зменшення маси тіла ≥5 %, спричиненого дієтою зі зниженою калорійністю, у 422 рандомізованих пацієнтів із ожирінням та надмірною масою тіла (305 пацієнтів завершили курс лікування) і артеріальною гіпертензією чи дисліпідемією.
Маса тіла
При застосуванні ліраглутиду було досягнуто кращого зниження маси тіла порівняно з плацебо у пацієнтів із ожирінням та надмірною масою тіла у всіх досліджуваних групах. У всіх популяціях дослідження більша частина пацієнтів досягала зниження маси тіла на ≥5 % та >10 % при застосуванні ліраглутиду порівняно з плацебо (таблиці 1–3). У 160-тижневій частині дослідження 1 зниження маси тіла відбувалося переважно в перший рік терапії і підтримувалося протягом всіх 160 тижнів.
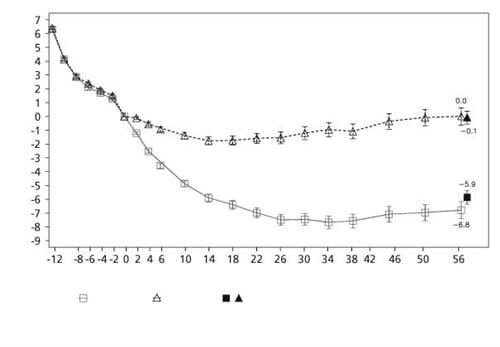
У дослідженні 4 при застосуванні ліраглутиду більше пацієнтів утримували результат зниження маси тіла, досягнутий до початку лікування, порівняно з плацебо (81,4 % та 48,9 % відповідно). Конкретні дані досліджень 1–4 щодо зниження маси тіла, терміну лікування та кумулятивного розподілу зміни маси тіла (%) представлені в таблицях 1–5 і на рисунках 1, 2 і 3.
Зниження маси тіла через 12 тижнів при лікуванні ліраглутидом (3,0 мг)
Особами, які мали ранню відповідь на лікування, були пацієнти, які досягли ≥ 5 % зниження маси тіла після 12 тижнів застосування терапевтичної дози ліраглутиду (4 тижні ескалації дози та 12 тижнів прийому лікувальної дози). У дослідженні 1 тривалістю 56 тижнів 67,5 % пацієнтів досягли ≥ 5 % зниження маси тіла після 12 тижнів. У дослідженні 2 50,4 % пацієнтів досягли зниження маси тіла ≥ 5 % через 12 тижнів. При продовженні лікування прогнозується, що 86,2 % пацієнтів досягнуть зниження маси тіла ≥ 5 %, а 51 % пацієнтів – ≥ 10 % після застосування ліраглутиду протягом року. Середнє зниження маси тіла у пацієнтів, які застосовували ліраглутид протягом року, становила 11,2 % від їх початкової маси тіла (9,7 % для чоловіків і 11,6 % для жінок). Серед пацієнтів, які досягли < 5 % зниження маси тіла після 12 тижнів терапії, частка пацієнтів, які після року застосування ліраглутиду не досягли зменшення маси тіла ≥ 10 %, становила 93,4 %.
Контроль глікемії
Лікування ліраглутидом значно покращило показники глікемії у пацієнтів з нормоглікемією, переддіабетом та цукровим діабетом 2 типу. У 56-тижневій частині дослідження 1 цукровий діабет 2 типу розвинувся у меншої кількості пацієнтів, які отримували ліраглутид, порівняно з пацієнтами, які отримували плацебо (0,2 % проти 1,1 % відповідно). У більшості пацієнтів з переддіабетом на початку лікування спостерігався зворотний розвиток даного захворювання після застосування ліраглутиду порівняно з плацебо (69,2 % проти 32,7 % відповідно). Первинною кінцевою точкою ефективності у 160-тижневій частині дослідження 1 була частка пацієнтів, у яких виник цукровий діабет 2 типу, оцінена як час до розвитку цукрового діабету. На 160-му тижні дослідження у 3 % пацієнтів, які отримували лікарський засіб Саксенда®, і в 11 % пацієнтів, які отримували плацебо, діагностували цукровий діабет 2 типу. Розрахунковий час розвитку цукрового діабету 2 типу у пацієнтів, які отримували ліраглутид 3 мг, був у 2,7 раза довший (95 % ДІ [1,9; 3,9]), а коефіцієнт ризику розвитку цукрового діабету 2 типу становив 0,2 для ліраглутиду порівняно з плацебо.
Кардіометаболічні фактори ризику
Лікування ліраглутидом значно покращило показники систолічного артеріального тиску та окружності талії порівняно з плацебо (таблиці 1, 2 та 3).
Індекс апное-гіпное (ІАГ)
При застосуванні ліраглутиду спостерігалось значне зниження тяжкості обструктивного апное під час сну порівняно з плацебо, яке було оцінене за допомогою зменшення порівняно з плацебо (таблиця 4).
Таблиця 1
Дослідження 1: зміни маси тіла, глікемії та кардіометаболічних показників на 56-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда® (N = 2437)
Плацебо (N = 1225)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
106,3 (21,2)
106,3 (21,7)
-
Середня зміна на 56-му тижні, % (95 % ДІ)
8,0
2,6
5,4** (–5,8; –5,0)
Середня зміна на 56-му тижні, кг (95 % ДІ)
8,4
2,8
5,6** (–6,0; –5,1)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ)
63,5
26,6
4,8** (4,1; 5,6)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ)
32,8
10,1
4,3** (3,5; 5,3)
Глікемія та кардіометаболічні фактори
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
HbA1c, %
5,6
0,3
5,6
0,1
0,23**
(–0,25; –0,21)
ГПН, ммоль/л
5,3
0,4
5,3
0,01
0,38**
(–0,42; –0,35)
Систолічний артеріальний тиск, мм рт. ст.
123,0
4,3
123,3
1,5
2,8** (–3,6; –2,1)
Діастолічний артеріальний тиск, мм рт. ст.
78,7
2,7
78,9
1,8
0,9* (–1,4; –0,4)
Окружність талії, см
115,0
8,2
114,5
4,0
4,2** (–4,7; –3,7)
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 2
Дослідження 1: зміни маси тіла, глікемії та кардіометаболічних показників на 160-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда®
(N = 1472)
Плацебо (N = 738)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
107,6 (21,6)
108,0 (21,8)
Середня зміна на 160-му тижні, % (95 % ДІ)
6,2
1,8
4,3**
(–4,9; –3,7)
Середня зміна на 160-му тижні, кг (95 % ДІ)
6,5
2,0
4,6**
(–5,3; –3,9)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 160-му тижні, % (95 % ДІ)
49,6
23,4
3,2**
(2,6; 3,9)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 160-му тижні, % (95 % ДІ)
24,4
9,5
3,1**
(2,3; 4,1)
Глікемія та кардіометаболічні фактори
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
HbA1c, %
5,8
0,4
5,7
0,1
0,21**
(–0,24; –0,18)
ГПН, ммоль/л
5,5
0,4
5,5
0,04
0,4**
(–0,5; –0,4)
Систолічний артеріальний тиск, мм рт. ст.
124,8
3,2
125,0
0,4
2,8**
(–3,8; –1,8)
Діастолічний артеріальний тиск, мм рт. ст.
79,4
2,4
79,8
1,7
0,6 (–1,3; 0,1)
Окружність талії, см
116,6
6,9
116,7
3,4
3,5**
(–4,2; –2,8)
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 160-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 160-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 3
Дослідження 2: зміни маси тіла, глікемії та кардіометаболічних показників на 56-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда® (N = 412)
Плацебо (N = 211)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
105,6 (21,9)
106,7 (21,2)
-
Середня зміна на 56-му тижні, % (95 % ДІ)
5,9
2,0
4,0** (–4,8; –3,1)
Середня зміна на 56-му тижні, кг (95 % ДІ)
6,2
2,2
4,1** (–5,0; –3,1)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ)
49,8
13,5
6,4** (4,1; 10,0)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ)
22,9
4,2
6,8** (3,4; 13,8)
Глікемія та кардіометаболічні фактори
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
HbA1c, %
7,9
1,3
7,9
0,4
0,9** (–1,1; –0,8)
ГПН, ммоль/л
8,8
1,9
8,6
0,1
1,8** (–2,1; –1,4)
Систолічний артеріальний тиск, мм рт. ст.
128,9
3,0
129,2
0,4
2,6* (–4,6; –0,6)
Діастолічний артеріальний тиск, мм рт. ст.
79,0
1,0
79,3
0,6
0,4 (–1,7; 1,0)
Окружність талії, см
118,1
6,0
117,3
2,8
3,2** (–4,2; –2,2)
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 4
Дослідження 3: зміни маси тіла та індексу апное-гіпопное на 32-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда® (N = 180)
Плацебо (N = 179)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
116,5 (23,0)
118,7 (25,4)
-
Середня зміна на 32-му тижні, % (95 % ДІ)
5,7
1,6
4,2** (–5,2; –3,1)
Середня зміна на 32-му тижні, кг (95 % ДІ)
6,8
1,8
4,9** (–6,2; –3,7)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 32-му тижні, % (95 % ДІ)
46,4
18,1
3,9** (2,4; 6,4)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 32-му тижні, % (95 % ДІ)
22,4
1,5
19,0** (5,7; 63,1)
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
Індекс апное-гіпопное, епізодів/годину
49,0
12,2
49,3
6,1
6,1* (–11,0; –1,2)
Повна вибірка пацієнтів. Для вихідних показників наведено середні величини, зміни на 32-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 32-му тижні є розрахунковими різницями між методами лікування (95 % ДІ). Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
СВ — стандартне відхилення.
Таблиця 5
Дослідження 4: зміна маси тіла на 56-му тижні порівняно з вихідною величиною
Маса тіла
Саксенда® (N = 207)
Плацебо (N = 206)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
100,7 (20,8)
98,9 (21,2)
-
Середня зміна на тижні 56, % (95 % ДІ)
6,3
0,2
6,1** (–7,5; –4,6)
Середня зміна на 56-му тижні, кг (95 % ДІ)
6,0
0,2
5,9** (–7,3; –4,4)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ)
50,7
21,3
3,8** (2,4; 6,0)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ)
27,4
6,8
5,1** (2,7; 9,7)
Повна вибірка пацієнтів. Для вихідних показників наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
** p < 0,0001.
ДІ – довірчий інтервал.
СВ – стандартне відхилення.
Зміна маси тіла (%)
Час, у тижнях
□ Саксенда® ∆Плацебо ■▲ Перенос даних останнього дослідження
Значення для пацієнтів, які завершують кожен плановий візит
Рисунок 3. Зміна маси тіла (%) від рандомізації (тиждень 0) за часом у дослідженні 4
До тижня 0 пацієнтів лікували лише за допомогою дієти зі зниженою калорійністю та фізичних вправ. На тижні 0 пацієнти були рандомізовані для застосування або лікарського засобу Саксенда®, або плацебо.
Імуногенність
Враховуючи потенційні імуногенні властивості лікарських засобів, що містять білки або пептиди, можна передбачити, що в пацієнтів можуть утворитися антитіла до ліраглутиду після застосування лікарського засобу Саксенда®. Під час клінічних досліджень у 2,5 % пацієнтів, які отримували ліраглутид, утворювались антитіла до ліраглутиду. Утворення антитіл не призводило до зниження ефективності ліраглутиду.
Вплив на серцево-судинну систему
Основні серйозні несприятливі серцево-судинні явища (МАСЕ), які були визначені зовнішньою незалежною експертною групою: нелетальний інфаркт міокарда, нелетальний інсульт, серцево-судинна смерть. В усіх тривалих клінічних дослідженнях лікарського засобу Саксенда® було зареєстровано 6 МАСЕ у пацієнтів, які отримували ліраглутид, та 10 МАСЕ у пацієнтів, які отримували плацебо. Відношення ризиків та ДІ 95 % при порівнянні лікарського засобу Саксенда® та плацебо становило 0,33 [0,12; 0,90].
У клінічних дослідженнях 3-ї фази спостерігалось підвищення частоти серцевих скорочень порівняно з вихідним значенням в середньому на 2,5 удара за хвилину (від 1,6 до 3,6 удара за хвилину в окремих дослідженнях). Максимальне збільшення частоти серцевих скорочень спостерігалося приблизно після 6 тижнів терапії. Тривалий клінічний вплив збільшення частоти серцевих скорочень не встановлений. Це збільшення було зворотним та зникало після припинення терапії ліраглутидом (див. розділ «Особливості застосування»).
У дослідженні LEADER® брали участь 9340 пацієнтів із недостатньо контрольованим цукровим діабетом 2 типу. Переважна кількість із них страждали на серцево-судинні захворювання. Пацієнтів рандомізовано розподіляли для застосування ліраглутиду у добовій дозі до 1,8 мг (4668) або плацебо (4672) на додаток до стандартного лікування.
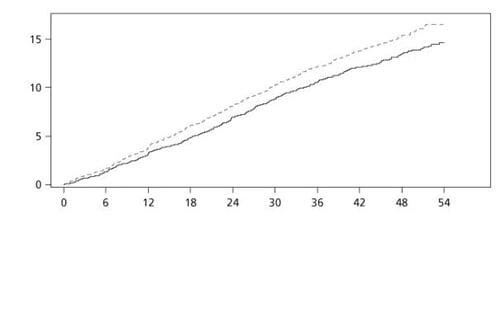
Тривалість терапії становила від 3,5 до 5 років. Середній вік пацієнтів становив 64 роки, середній ІМТ – 32,5 кг/м². Середнє значення початкового рівня HbA1c становило 8,7 і покращилося через 3 роки на 1,2 % у пацієнтів, яким був призначений ліраглутид, та на 0,8 % у пацієнтів, яким було призначено плацебо. Первинною кінцевою точкою ефективності був час від рандомізації до першого виникнення будь-яких основних MACE: нелетального інфаркту міокарда, нелетального інсульту, серцево-судинної смерті. Ліраглутид значно знизив частоту виникнення основних несприятливих серцево-судинних явищ (події первинної кінцевої точки, MACE) порівняно з плацебо (3,41 проти 3,90 на 100 пацієнто-років у групах ліраглутиду та плацебо відповідно), зменшивши ризик на 13 %, відношення ризиків (HR) – 0,87, [0,78; 0,97] [95 % ДІ]) (р = 0,005) (див. Рисунок 4).
Пацієнти з подією (%)
Час від рандомізації (місяці)
HR: 0,87
95 % ДІ 0,78; 0,97;
р<0,001 для не меншої
ефективності;
р=0,005 для вищої ефективності
- - - - - - плацебо
ліраглутид
Пацієнтів у групі ризику
Плацебо
4672
4587
4473
4352
4237
4123
4010
3914
1543
407
Ліраглутид
4668
4593
4496
4400
4280
4172
4072
3982
1562
424
FAS: Повний набір аналізів
Рисунок 4. Графік Каплана — Маєра час до першої події MACE — популяція FAS
Подвійно сліпе дослідження ефективності і безпеки застосування лікарського засобу Саксенда® порівняно з плацебо для зниження маси тіла у пацієнтів дитячого віку від 12 років з ожирінням показало, що лікарський засіб Саксенда® є більш ефективним, ніж плацебо, для зниження маси тіла (яке оцінювалось за шкалою стандартного відхилення ІМТ або Z-score) через 56 тижнів лікування (табл. 6).
Серед пацієнтів, які приймали ліраглутид, більший відсоток пацієнтів досяг зниження ІМТ на ≥ 5 % та ≥ 10 %, ніж серед пацієнтів, які приймали плацебо. В середньому зниження ІМТ та маси тіла також було більшим у групі пацієнтів, які приймали ліраглутид (табл. 6). Після 26 тижнів періоду подальшого спостереження без застосування досліджуваного лікарського засобу спостерігалося відновлення маси тіла у пацієнтів, які приймали ліраглутид, порівняно з тими, хто приймав плацебо (табл. 6).
Таблиця 6
Дослідження 4180: зміни від вихідного рівня маси тіла та ІМТ на 56-му тижні та зміна за шкалою стандартного відхилення ІМТ (BMI SDS) від 56-го тижня до 82-го тижня
Саксенда® (N=125)
Плацебо (N=126)
Саксенда® порівняно з плацебо
BMI SDS
Вихідний показник, BMI SDS (СВ)
3,14 (0,65)
3,20 (0,77)
Середня зміна на 56-му тижні
(95 % ДІ)
0,23
0,00
0,22* (-0,37; -0,08)
56-й тиждень, BMI SDS (СВ)
2,88 (0,94)
3,14 (0,98)
Середня зміна від 56-го тижня до 82-го тижня, BMI SDS (95 % ДІ)
0,22
0,07
0,15** (0,07; 0,23)
Маса тіла
Вихідний показник, кг (СВ)
99,3 (19,7)
102,2 (21,6)
-
Середня зміна на 56-му тижні, % (95 % ДІ)
2,65
2,37
5,01** (-7,63; -2,39)
Середня зміна на 56-му тижні, кг (95 % ДІ)
2,26
2,25
4,50** (-7,17; -1,84)
ІМТ
Вихідний показник, кг/м2 (СВ)
35,3 (5,1)
35,8 (5,7)
-
Середня зміна на 56-му тижні, кг/м2 (95 % ДІ)
1,39
0,19
1,58** (-2,47; -0,69)
Відсоток пацієнтів зі зниженням на ≥ 5 % вихідного ІМТ на 56-му тижні, % (95 % ДІ)
43,25
18,73
3,31** (1,78; 6,16)
Відсоток пацієнтів зі зниженням на ≥ 10 % вихідного ІМТ на
56-му тижні, % (95 % ДІ)
26,08
8,11
4,00** (1,81; 8,83)
Повна вибірка пацієнтів. Для BMI SDS, маси тіла та ІМТ вихідні показники є середніми величинами, зміни від вихідного рівня на 56-му тижні є розрахованими середніми величинами (методом найменших квадратів), а відмінності в лікуванні на 56-му тижні – це розраховані різниці між методами лікування. Для BMI SDS показники на 56-му тижні є середніми величинами, зміни від 56-го тижня до 82-го тижня є розрахованими величинами (методом найменших квадратів), а відмінності в лікуванні на 82-му тижні – це розраховані різниці між методами лікування. Для частки пацієнтів, які втратили ≥ 5 % / ≥ 10 % вихідного ІМТ, також наведено розраховане співвідношення шансів. Пропущені спостереження інтерпольовані з групи пацієнтів, які приймали плацебо, на основі переходу до референційного підходу множинної (x100) підстановки даних.
* p < 0,01, ** p < 0,001. ДІ – довірчий інтервал. СВ – стандартне відхилення.
Відповідно до переносимості лікарського засобу 103 пацієнти (82,4 %) збільшили дозу та продовжували приймати дозу 3,0 мг, 11 пацієнтів (8,8 %) збільшили дозу та продовжували приймати дозу 2,4 мг, 4 пацієнти (3,2 %) збільшили дозу та продовжували приймати дозу 1,8 мг, 4 пацієнти (3,2 %) збільшили дозу та продовжували приймати дозу 1,2 мг і 3 пацієнти (2,4 %) продовжували приймати дозу 0,6 мг.
Через 56 тижнів лікування не було зареєстровано жодного впливу на ріст чи статеве дозрівання пацієнтів.
Дослідження з 16-тижневим подвійно сліпим періодом і 36-тижневим відкритим періодом було проведено для оцінки ефективності та безпеки застосування лікарського засобу Саксенда® педіатричним пацієнтам із синдромом Прадера – Віллі та ожирінням. Дослідження включало 32 пацієнти віком від 12 до 18 років (частина А) та 24 пацієнти віком від 6 до 12 років (частина В). Пацієнти були рандомізовані в співвідношенні 2:1 для прийому лікарського засобу Саксенда® або плацебо. Пацієнти з масою тіла менше 45 кг почали збільшувати дозу на меншу величину (0,3 мг замість 0,6 мг) та збільшували до максимальної дози 2,4 мг.
Розрахована різниця в лікуванні за середніми значеннями ІМТ SDS на 16 тижні (частина A: -0,20 проти -0,13, частина B: -0,50 проти -0,44) і на 52 тижні (частина A: -0,31 проти -0,17, частина B: -0,73 проти - 0,67) була подібною при застосуванні лікарського засобу Саксенда® та плацебо.
Жодних додаткових проблем щодо безпеки під час дослідження не було помічено.
Європейське агентство з лікарських засобів відклало зобов'язання подавати результати досліджень застосування лікарського засобу Саксенда® в одній або декількох підгрупах дитячого населення при лікуванні ожиріння та при лікуванні синдрому Прадера-Віллі (див. Розділ «Спосіб застосування та дози»).
Фармакокінетика.
Абсорбція
Абсорбція ліраглутиду після підшкірного введення відбувається повільно, максимальна концентрація досягається приблизно через 11 годин після введення. У пацієнтів, які страждають на ожиріння (ІМТ 30-40 кг/м2), після введення 3 мг ліраглутиду його середня рівноважна концентрація (AUCt/24) досягала приблизно 31 нмоль/л. Експозиція ліраглутиду збільшувалася пропорційно дозі. Абсолютна біодоступність ліраглутиду після підшкірного введення становить приблизно 55 %.
Розподіл
Середній видимий об’єм розподілу після підшкірного введення становить 20–25 л (для людини з масою тіла приблизно 100 кг). Ліраглутид значною мірою зв’язується з білками плазми крові (>98 %).
Метаболізм
Протягом 24 годин після введення разової дози [3H]-ліраглутиду здоровим добровольцям основним компонентом у плазмі крові був незмінений ліраглутид. У плазмі крові були виявлені в незначній кількості два метаболіти (≤ 9 % і ≤ 5 % від загального рівня радіоактивності у плазмі крові).
Виведення
Ліраглутид ендогенно метаболізується, як і всі великі білки, без участі специфічного органу як основного шляху елімінації. Після введення дози [3H]-ліраглутиду в сечі і калі не було виявлено незміненого ліраглутиду. Тільки невелика частка введеної радіоактивності у вигляді метаболітів ліраглутиду виводилась нирками та через кишечник (6 % і 5 % відповідно). Радіоактивні речовини виводяться нирками або через кишечник в основному протягом перших 6 – 8 діб у вигляді трьох метаболітів.
Після одноразового підшкірного введення ліраглутиду середнє значення кліренсу становить приблизно 0,9-1,4 л/годину, період напіввиведення – приблизно 13 годин.
Особливі групи пацієнтів
Пацієнти літнього віку
На підставі даних фармакокінетичного аналізу групи пацієнтів віком від 18 до 82 років з надмірною масою тіла чи ожирінням був зроблений висновок, що вік не має клінічно значущого впливу на фармакокінетику ліраглутиду. Тому немає необхідності в коригуванні дози відносно віку.
Стать
Дані фармакокінетичного аналізу показали, що у жінок спостерігається на 24 % нижчий кліренс ліраглутиду порівняно з чоловіками. На підставі цих даних можна зробити висновок, що корекція дози відносно статі не потрібна.
Етнічне походження
На підставі даних фармакокінетичного аналізу групи пацієнтів європеоїдної, монголоїдної, латиноамериканської і негроїдної рас з надмірною масою тіла чи ожирінням був зроблений висновок, що етнічне походження не виявляє будь-якого істотного клінічного впливу на фармакокінетику ліраглутиду.
Маса тіла
Експозиція ліраглутиду зменшується зі збільшенням початкової маси тіла. Як показали дослідження, добова доза ліраглутиду 3,0 мг забезпечує нормальний системний вплив на організм пацієнта з масою тіла 60-234 кг. Експозиція ліраглутиду у пацієнтів з масою тіла більше 234 кг не вивчалась.
Порушення функції печінки
Фармакокінетику ліраглутиду досліджували у пацієнтів із різним ступенем порушень функції печінки у процесі дослідження із застосуванням одноразової дози (0,75 мг). Було показано, що у пацієнтів з легкими і помірними порушеннями функції печінки експозиція ліраглутиду знижувалася на 13-23 % порівняно зі здоровими добровольцями. У пацієнтів з тяжкими порушеннями функції печінки (>9 балів за класифікацією Чайлда – П’ю) експозиція була значно нижча (на 44 %).
Порушення функції нирок
Експозиція ліраглутиду була знижена у пацієнтів з порушеннями функції нирок порівняно з особами з нормальною функцією нирок у процесі дослідження із застосуванням одноразової дози (0,75 мг). У пацієнтів з легкими порушеннями (кліренс креатиніну 50-80 мл/хв) експозиція знижувалася на 33 %, з порушеннями помірної тяжкості (кліренс креатиніну 30 – 50 мл/хв) – на 14 %, з тяжкими порушеннями (кліренс креатиніну <30 мл/хв) – на 27 %, а на кінцевих стадіях захворювань нирок, що вимагають проведення діалізу, – на 26 %.
Діти
Фармакокінетичні властивості ліраглутиду в дозі 3,0 мг було оцінено в ході клінічних досліджень за участю пацієнтів дитячого віку ≥ 12 років з ожирінням (134 пацієнти з масою тіла 62–178 кг).
Експозиція ліраглутиду у дітей ≥ 12 років була подібною до експозиції у дорослих з ожирінням.
Фармакокінетичні властивості також оцінювали у ході клініко-фармакологічного дослідження за участю пацієнтів дитячого віку 7–11 років з ожирінням (13 пацієнтів, маса тіла 54–87 кг) .
Було виявлено порівнянну експозицію при введенні 3,0 мг ліраглутиду у дорослих, дітей ≥ 12 років та дітей віком 7-11 років після корекції маси тіла.
Доклінічні дані з безпеки
Доклінічні дані, що базуються на дослідженнях з фармакологічної безпеки, токсичності повторних доз та генотоксичності, не виявили жодного ризику для людини.
У процесі дворічних досліджень канцерогенності у щурів та мишей були виявлені пухлини С-клітин щитоподібної залози, що не призводили до летального результату. Нетоксична доза (NOAEL) у щурів не була встановлена. У мавп, що отримували лікування протягом 20 місяців, таких пухлин не виявлено. Пухлини у гризунів обумовлені негенотоксичним специфічним ГПП-1-рецептор-опосередкованим механізмом, до якого частково чутливі гризуни. Значущість цього механізму у людей достатньо низька, але не може бути повністю виключена. Розвитку інших пухлин не було виявлено. У процесі досліджень на тваринах не було виявлено прямого шкідливого впливу на фертильність, проте при введенні найвищих доз відзначалося незначне підвищення ранньої ембріональної летальності. Введення ліраглутиду в період середини вагітності спричиняло зниження маси тіла самки, уповільнення росту плода з нез’ясованим впливом на розвиток ребер у щурів і скелета у кроликів. При введенні ліраглутиду відзначено уповільнення росту новонароджених щурів, що зберігається в період відлучення від годування молоком у групі прийому високої дози. Невідомо, чи уповільнення росту новонароджених щурів обумовлене зниженням споживання ними молока в результаті прямого впливу ГПП-1, чи зменшенням молока у матері, що обумовлено зниженням калорійності споживаної їжі.
У ювенільних щурів застосування ліраглутиду призводило до затримки статевого дозрівання як самців, так і самок за клінічно значимих концентрацій препарату в плазмі крові. Такі затримки не впливали на фертильність і репродуктивну здатність самок та самців чи на здатність самок виношувати вагітність.
Діти
Дослідження лікарської взаємодії проводились лише за участю дорослих пацієнтів.
Діти
У дітей ≥ 12 років, які отримували лікування ліраглутидом, повідомлялося про епізоди клінічно значущої гіпоглікемії. Пацієнтів слід проінформувати про характерні симптоми гіпоглікемії та відповідні заходи.
Гіперглікемія у пацієнтів з цукровим діабетом 2 типу, які отримують інсулін
У пацієнтів з цукровим діабетом 2 типу лікарський засіб Саксенда® не можна застосовувати як заміну інсуліну. Повідомлялося про розвиток діабетичного кетоацидозу у інсулінозалежних пацієнтів у разі швидкого припинення застосування або зменшення дози інсуліну (див. розділ «Спосіб застосування та дози»).
Допоміжні речовини
Саксенда® містить менше ніж 1 ммоль натрію (23 мг), тому лікарський засіб можна вважати таким, що не містить натрію.
Діти
Для дітей віком від 12 років корекція дози не потрібна. Безпеку та ефективність застосування лікарського засобу Саксенда® дітям віком до 12 років не встановлено (див. розділ «Фармакодинаміка»).
Діти
У ході клінічного дослідження за участю дітей віком від 12 років із ожирінням 125 пацієнтів приймали лікарський засіб Саксенда® впродовж 56 тижнів.
Загалом частота, тип і тяжкість небажаних реакцій у дітей ≥ 12 років з ожирінням були зіставними із такими у дорослих пацієнтів. Порівняно з дорослими пацієнтами у дітей від 12 років удвічі частіше спостерігалось блювання.
Відсоток пацієнтів, які повідомили принаймні про один епізод клінічно значущої гіпоглікемії, був вищим у групі застосування ліраглутиду (1,6 %), ніж у групі плацебо (0,8 %). Під час проведення дослідження не зареєстровано жодного епізоду тяжкої гіпоглікемії.
Повідомлення про небажані реакції та відсутність ефективності лікарського засобу
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням https://aisf.dec.gov.ua.
Показання
Лікарський засіб Саксенда® застосовують для зменшення маси тіла як доповнення до дієти зі зниженою калорійністю та збільшеною фізичною активністю у дорослих пацієнтів з початковим індексом маси тіла (ІМТ) більше 30 кг/м2 (ожиріння) або від 27 до 30 кг/м2 (надмірна маса тіла) за наявності хоча б одного супутнього захворювання, пов’язаного з масою тіла, такого як дисглікемія (переддіабет або цукровий діабет 2 типу), гіпертензія, дисліпідемія або обструктивне апное сну.
Якщо через 12 тижнів після прийому добової дози 3,0 мг пацієнт не втратив щонайменше 5 % від початкової маси тіла, застосування лікарського засобу Саксенда® слід припинити.
Діти ≥ 12 років
Лікарський засіб Саксенда® можна застосовувати як доповнення до здорового харчування та збільшеної фізичної активності для корекції маси тіла у пацієнтів дитячого віку від 12 років із:
ожирінням (ІМТ ≥ 30 кг/м2 для дорослих пацієнтів за міжнародними гранично допустимими значеннями)* та
масою тіла більш ніж 60 кг.
Лікування препаратом Саксенда® слід припинити і переглянути, якщо пацієнт не втратив щонайменше 4 % свого ІМТ або ІМТ за оцінкою Z-score через 12 тижнів застосування препарату в дозі 3,0 мг/добу чи в максимальній переносимій дозі.
* Гранично допустимі значення ІМТ, встановлені Міжнародною робочою групою з вивчення ожиріння, для пацієнтів віком 12–18 років із ожирінням у розбивці за статтю (див. табл. 7).
Таблиця 7
Гранично допустимі значення ІМТ, встановлені Міжнародною робочою групою з вивчення ожиріння, для пацієнтів із ожирінням у віці 12–18 років у розбивці за статтю
Вік
(років)
ІМТ, який відповідає 30 кг/м2 для дорослих пацієнтів за міжнародними гранично допустимими значеннями
Хлопці
Дівчата
12
26,02
26,67
12,5
26,43
27,24
13
26,84
27,76
13,5
27,25
28,20
14
27,63
28,57
14,5
27,98
28,87
15
28,30
29,11
15,5
28,60
29,29
16
28,88
29,43
16,5
29,14
29,56
17
29,41
29,69
17,5
29,70
29,84
18
30,00
30,00
Підвищена чутливість до діючої речовини або до інших компонентів лікарського засобу.
Взаємодія з іншими лікарськими засобами та інші види взаємодії
Іn vitro ліраглутид продемонстрував дуже низький потенціал впливу на фармакокінетику інших активних субстанцій, обмін яких пов’язаний із цитохромом Р450, а також зв’язування з білками плазми крові.
Ліраглутид спричинює незначну затримку випорожнення шлунка, що може вплинути на всмоктування пероральних препаратів, що застосовуються одночасно. Дослідження щодо взаємодії не показали будь-якого клінічно значущого уповільнення всмоктування, тому корекція дози не потрібна.
Дослідження взаємодії проводили при застосуванні ліраглутиду в дозі 1,8 мг. Вплив на швидкість випорожнення шлунка був еквівалентним до ліраглутиду в дозі 1,8 мг та 3,0 мг (парацетамол AUC0-300 хв). Зареєстрований щонайменше один епізод виникнення гострої діареї у деяких пацієнтів, які отримували лікарський засіб Саксенда®. Діарея може порушувати всмоктування пероральних лікарських засобів, що одночасно приймаються.
Варфарин та інші похідні кумарину
Досліджень лікарської взаємодії не проводили. Не можна виключити клінічно значущу взаємодію з активною субстанцією, що має низьку розчинність або вузький терапевтичний індекс, такою як варфарин. На початку лікування ліраглутидом у пацієнтів, які одержують варфарин або інші похідні кумарину, рекомендується частіше проводити контроль міжнародного нормалізованого співвідношення (МНС).
Парацетамол
Ліраглутид не змінював загальну експозицію парацетамолу після введення одноразової дози 1000 мг. Максимальна концентрація парацетамолу (Cmax) знижувалася на 31 %, а медіана часу досягнення максимальної концентрації (tmax) збільшувалася до 15 хвилин. При одночасному застосуванні парацетамолу корекція дози не потрібна.
Аторвастатин
Ліраглутид не змінював загальну експозицію аторвастатину до клінічно значущого рівня після одноразового його введення в дозі 40 мг. У зв’язку з цим при одночасному застосуванні з ліраглутидом корекція дози аторвастатину не потрібна. При одночасному введенні з ліраглутидом Cmax аторвастатину знижувалася на 38 %, а медіана tmax збільшувалася з 1 години до 3 годин.
Гризеофульвін
Ліраглутид не змінював загальної експозиції гризеофульвіну після одноразового його введення в дозі 500 мг. Cmax гризеофульвіну зростала на 37 %, тоді як медіана tmax не змінювалася. Коригування дози гризеофульвіну та інших низькорозчинних сполук з високою проникністю не потрібне.
Дигоксин|
Після одноразового введення 1 мг дигоксину у поєднанні з ліраглутидом відмічено зменшення значення площі під кривою «концентрація-час» (AUC) для дигоксину на 16 %; Cmax знижувалася на 31 %. Медіана tmax дигоксину збільшувалася з 1 години до 1,5 години. Виходячи з даних результатів, корекція дози дигоксину не потрібна.
Лізиноприл
Після одноразового застосування 20 мг лізиноприлу з ліраглутидом відмічено зменшення AUC для лізиноприлу на 15 %, Cmax знижувалася на 27 %. Медіана tmax лізиноприлу збільшувалася з 6 до 8 годин. Виходячи з даних результатів, корекція дози лізиноприлу не потрібна.
Пероральні контрацептиви
При одночасному застосуванні разової дози пероральних контрацептивів ліраглутид знижував Cmax етинілестрадіолу або левоноргестрелу на 12 % і 13 % відповідно, а tmax збільшувався на 1,5 години. Це не мало клінічно значущого впливу на загальну експозицію етинілестрадіолу або левоноргестрелу, що дає підставу вважати, що одночасний прийом їх з ліраглутидом не вплине на контрацептивний ефект етинілестрадіолу та левоноргестрелу.
Спостереження
З метою покращення спостереження за біологічними лікарськими засобами, назва та номер серії препарату, що вводиться, повинні бути чітко записані.
Аспірація в поєднанні із загальною анестезією або глибокою седацією
У пацієнтів, які отримували агоністи рецепторів ГПП-1, спостерігалися випадки легеневої аспірації під час їх перебування під загальною анестезією або у стані глибокої седації. Тому перед виконанням процедури із використанням загальної анестезії або глибокої седації слід враховувати підвищений ризик наявності залишкового вмісту шлунка внаслідок затримки випорожнення шлунка (див. розділ «Побічні реакції»).
Серцева недостатність
Немає клінічного досвіду лікування пацієнтів із застійною серцевою недостатністю IV класу за класифікацією Нью-Йоркської асоціації кардіологів (NYHA), тому ліраглутид не рекомендовано застосовувати цим пацієнтам.
Особливі групи пацієнтів
Безпека та ефективність застосування ліраглутиду для корекції маси тіла не встановлені у пацієнтів:
віком ≥ 75 років;
які застосовують інші лікарські засоби для корекції маси тіла;
із вторинним ожирінням, викликаним ендокринологічними розладами чи розладами, пов’язаними з харчуванням, або в результаті застосування лікарських засобів, що можуть спричинити збільшення маси тіла;
з тяжким порушенням функції нирок;
з тяжким порушенням функції печінки.
Не рекомендується застосовувати лікарський засіб Саксенда® даним групам пацієнтів (див. розділ «Дозування»).
Оскільки дослідження щодо застосування ліраглутиду для корекції маси тіла в пацієнтів з легкими або помірними порушеннями функції печінки відсутні, його слід з обережністю застосовувати цій групі пацієнтів (див. розділи «Фармакокінетика» та «Дозування»).
Досвід застосування ліраглутиду у пацієнтів із запальними захворюваннями кишечнику і діабетичним гастропарезом обмежений. Застосування ліраглутиду цим пацієнтам не рекомендовано, оскільки воно супроводжується тимчасовими побічними реакціями з боку шлунково-кишкового тракту, в т. ч. нудотою, блюванням і діареєю.
Панкреатит
Спостерігались випадки гострого панкреатиту при застосуванні аналогів рецептора ГПП-1.
Пацієнтів слід проінформувати про характерні симптоми гострого панкреатиту. При підозрі на панкреатит слід відмінити лікування ліраглутидом. Якщо підтверджується гострий панкреатит, повторне застосування ліраглутиду не рекомендоване.
Жовчнокам’яна хвороба та холецистит
У клінічних випробуваннях у пацієнтів, які застосовували ліраглутид для зменшення маси тіла, спостерігалася більша частота виникнення жовчнокам’яної хвороби та холециститу порівняно з пацієнтами, які отримували плацебо. Той факт, що швидка втрата маси тіла може збільшити ризик розвитку жовчнокам’яної хвороби і, отже, холециститу, лише частково пояснює більш високу частоту виникнення даних захворювань при застосуванні ліраглутиду. Жовчнокам’яна хвороба та холецистит можуть призвести до госпіталізації та холецистектомії. Пацієнтів слід поінформувати про характерні симптоми жовчнокам’яної хвороби та холециститу.
Захворювання щитоподібної залози
У процесі клінічних досліджень цукрового діабету 2 типу відмічені побічні реакції з боку щитоподібної залози, такі як зоб, особливо у пацієнтів з уже наявними захворюваннями щитоподібної залози. Тому ліраглутид слід з обережністю застосовувати цим пацієнтам.
Частота серцевих скорочень
Під час клінічних досліджень ліраглутиду спостерігалося збільшення частоти серцевих скорочень (див. розділ «Фармакодинаміка»). Частоту серцевих скорочень слід контролювати через рівні проміжки часу відповідно до звичайної клінічної практики. Пацієнтів слід проінформувати про симптоми збільшення частоти серцевих скорочень (підвищене серцебиття або відчуття підвищеного серцебиття в спокої). Пацієнтам, у яких спостерігається клінічно значуще стійке збільшення частоти серцевих скорочень у спокої, лікування ліраглутидом слід припинити.
Зневоднення
У пацієнтів, які застосовували агоністи рецепторів ГПП-1, спостерігалися симптоми зневоднення, в тому числі порушення функції нирок та гострої ниркової недостатності. Пацієнтів, яким призначено ліраглутид, необхідно проінформувати про можливість зневоднення організму внаслідок розладів травної системи та необхідність вживання запобіжних заходів щодо зневоднення.
Гіпоглікемія у пацієнтів з цукровим діабетом 2 типу
У пацієнтів із цукровим діабетом 2 типу, які отримують ліраглутид одночасно з інсуліном та/або сульфонілсечовиною, може бути підвищений ризик виникнення гіпоглікемії. Ризик виникнення гіпоглікемії може бути знижений за допомогою зменшення дози інсуліну та/або сульфонілсечовини.
Вагітність
Адекватні дані щодо застосування ліраглутиду вагітним жінкам відсутні. Дослідження на тваринах показали репродуктивну токсичність (див. розділ «Доклінічні дані з безпеки»). Потенційний ризик для людей невідомий.
Ліраглутид не слід застосовувати під час вагітності. Якщо пацієнтка хоче завагітніти або вагітна, то прийом ліраглутиду необхідно відмінити.
Період годування груддю
Невідомо, чи екскретується ліраглутид у грудне молоко людини. Дослідження на тваринах показали, що в молоко потрапляє незначна кількість ліраглутиду і його близькоспоріднених структурних метаболітів. Доклінічні дослідження виявили пов’язане із застосуванням препарату зменшення темпів зростання новонароджених щуренят (див. розділ «Доклінічні дані про безпеку застосування»). У зв’язку з недостатнім досвідом застосування препарату у період годування груддю не слід застосовувати його в цей період.
Фертильність
Окрім незначного зменшення кількості живих імплантованих ембріонів, дослідження на тваринах не виявили шкідливого впливу препарату на репродуктивну здатність (див. розділ «Доклінічні дані про безпеку застосування»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Лікарський засіб Саксенда® не впливає або має незначний вплив на здатність керувати транспортними засобами й іншими механізмами. Однак може виникати запаморочення здебільшого протягом перших 3 місяців лікування лікарським засобом Саксенда®. Слід з обережністю керувати автотранспортом або іншими механізмами при виникненні запаморочення.
Дорослі
Початкова доза становить 0,6 мг на добу. Для поліпшення переносимості з боку шлунково-кишкового тракту дозу слід підвищувати щотижня на 0,6 мг до досягнення добової дози 3,0 мг (див. таблицю 8).
У разі поганої переносимості наступної підвищеної дози протягом двох послідовних тижнів слід розглянути питання про припинення лікування. Добова доза вище 3,0 мг не рекомендується.
Таблиця 8
Графік підвищення дози
Доза, мг
Тижні
Збільшення дози протягом
4 тижнів
0,6
1
1,2
1
1,8
1
2,4
1
Підтримуюча доза
3,0 мг
Діти ≥ 12 років
Для дітей віком від 12 років слід застосовувати таку ж схему підвищення дози, як і для дорослих (див. таблицю 8). Дозу слід збільшувати до досягнення 3,0 мг (підтримуюча доза) або максимальної переносимої дози. Добові дози вище 3,0 мг не рекомендуються.
Пропущена доза
Якщо ін’єкція пропущена протягом 12 годин з моменту її звичайного введення, пацієнт повинен прийняти дозу якнайшвидше. Якщо до наступного введення залишається менше 12 годин, пацієнт не повинен приймати пропущену дозу, а продовжувати режим прийому 1 раз на добу – прийняти наступну заплановану дозу препарату. Не слід приймати додаткову дозу чи збільшувати дозу для компенсації пропущеної ін’єкції.
Пацієнти з цукровим діабетом 2 типу
Лікарський засіб Саксенда® не слід застосовувати в комбінації з іншими агоністами рецепторів ГПП-1. Для зниження ризику розвитку гіпоглікемії на початку застосування лікарського засобу Саксенда® слід розглянути можливість зменшення дози одночасно застосовуваних інсуліну або стимуляторів секреції інсуліну (наприклад, сульфонілсечовини). Необхідний самоконтроль рівня глюкози в крові для коригування дози інсуліну чи стимуляторів секреції інсуліну (див. розділ «Особливості застосування»).
Особливі групи пацієнтів
Пацієнти літнього віку (≥65 років)
Корекція дози у зв’язку з віком не потрібна. Досвід застосування препарату пацієнтам ≥75 років обмежений, тому не рекомендовано застосовувати його даній категорії пацієнтів (див. розділи «Фармакокінетика» та «Особливості застосування»).
Пацієнти з порушеннями функції нирок
Корекція дози не потрібна у пацієнтів з легким або середнім ступенем порушення функції нирок (кліренс креатиніну ≥30 мл/хв). Не рекомендується застосовувати лікарський засіб Саксенда® пацієнтам з тяжким порушенням функції нирок (кліренс креатиніну <30 мл/хв), включаючи пацієнтів із термінальною стадією порушення функції нирок (див. розділи «Фармакокінетика», «Особливості застосування» та «Побічні реакції»).
Пацієнти з порушеннями функції печінки
Не рекомендується коригування дози пацієнтам з легким або середнім ступенем порушення функції печінки. Застосування лікарського засобу Саксенда® не рекомендується пацієнтам з тяжким порушенням функції печінки, а пацієнтам із легким або помірним порушенням функції печінки препарат слід застосовувати з обережністю (див. розділи «Фармакокінетика» та «Особливості застосування»).
Спосіб введення
Лікарський засіб Саксенда® призначений тільки для підшкірного введення. Його не можна вводити внутрішньовенно або внутрішньом’язово.
Препарат вводять підшкірно 1 раз на добу у будь-який час незалежно від вживання їжі. Його можна вводити підшкірно в ділянку передньої черевної стінки, стегна або плеча. Місце і час введення можна змінювати без корекції дози, проте бажано вводити приблизно в один і той же найбільш зручний час.
Нижче наводиться інструкція з використання шприц-ручки для введення лікарського засобу.
З метою зменшення ризику утворення відкладень амілоїдози при ін’єкції, необхідно завжди змінювати місце ін’єкції (див. розділ «Побічні рекації»).
Інструкція з використання шприц-ручки Саксенда®
Перед використанням шприц-ручки Саксенда® необхідно уважно причитати цю інструкцію.
Не користуватися шприц-ручкою без отримання належної інформації щодо її використання від лікаря чи медсестри.
препарату необхідно почати з перевірки шприц-ручки, щоб бути впевненим, що вона містить саме лікарський засіб Саксенда®, 6 мг/мл. Потім потрібно подивитися рисунки нижче, щоб дізнатися про різні частини шприц-ручки та голки.
Незрячим пацієнтам та пацієнтам з поганим зором не можна користуватися шприц-ручкою без сторонньої допомоги. Допомагати має людина з хорошим зором, яка може побачити лічильник дози на шприц-ручці Саксенда® та яка вміє користуватися нею.
Шприц-ручка Саксенда® є попередньо заповненою. Вона містить 18 мг ліраглутиду, що дає змогу ввести дози 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг та 3,0 мг. Шприц-ручка Саксенда® призначена для використання з одноразовими голками НовоФайн® або НовоТвіст® довжиною до 8 мм і товщиною 32G. Голки не входять у комплект.
Важлива інформація
Необхідно звернути особливу увагу на цю позначку, оскільки вона є важливою для безпечного користування шприц-ручкою.
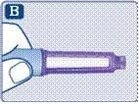
Шприц-ручка Саксенда® та голка (приклад)
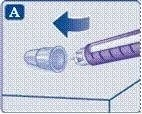
1. Підготовка шприц-ручки з новою голкою для використання
;Перевірте назву та кольорову етикетку Вашої шприц-ручки, щоб бути впевненим, що вона містить лікарський засіб Саксенда®. Це особливо важливо в тому випадку, якщо Ви застосовуєте різні ін’єкційні лікарські засоби. Застосування неправильного лікарського засобу може бути шкідливим для Вашого здоров’я.
;Зніміть ковпачок шприц-ручки.
;Переконайтеся, що розчин у шприц-ручці прозорий та безбарвний. Подивіться у вікно шкали картриджа. Якщо препарат мутний, шприц-ручку використовувати заборонено.
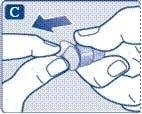
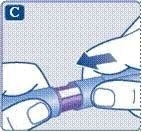
;Візьміть нову одноразову голку та видаліть з неї захисну мембрану.
;Переконайтеся, що голка прикріплена правильно.
;Нагвинтіть голку на шприц-ручку та поверніть її, щоб голка щільно трималась на шприц-ручці.
;Голка закрита двома ковпачками. Ви повинні зняти обидва ковпачки. Якщо ви забудете зняти обидва ковпачки, ви не зробите ін’єкцію розчину.
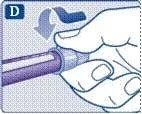
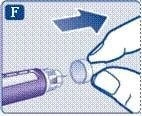
;Зніміть зовнішній ковпачок голки та збережіть його. Він знадобиться після завершення ін’єкції для безпечного зняття голки.
;Зніміть внутрішній ковпачок голки та викиньте його. Якщо Ви спробуєте надіти внутрішній ковпачок знову на голку, то можете поранитись. На кінці голки може з’явитися крапля розчину. Це нормальне явище, проте необхідно перевірити надходження препарату при використанні нової шприц-ручки вперше.
Не приєднуйте нову голку до тих пір, поки не будете готові зробити ін’єкцію.
![]() Для кожної ін’єкції завжди використовуйте нову
голку. Це зменшить ризик закупорки голки, зараження, потрапляння інфекції та введення неправильної дози препарату.
Для кожної ін’єкції завжди використовуйте нову
голку. Це зменшить ризик закупорки голки, зараження, потрапляння інфекції та введення неправильної дози препарату.
![]() Ніколи не використовуйте голку, якщо вона погнута чи
пошкоджена.
Ніколи не використовуйте голку, якщо вона погнута чи
пошкоджена.
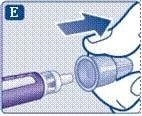
2. Перевірка потоку розчину з кожної нової шприц-ручки
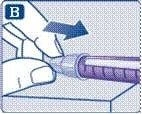
Якщо Ви вже використовували цю шприц-ручку, переходьте до пункту 3 «Виставлення дози». Перевіряйте потік розчину лише перед першим застосуванням нової шприц-ручки.
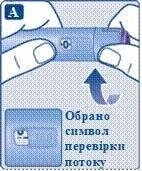
Повертайте селектор дози до символу перевірки потоку
( ![]() ) прямо після «0». Переконайтеся, що символ перевірки
потоку збігається з покажчиком дози.
) прямо після «0». Переконайтеся, що символ перевірки
потоку збігається з покажчиком дози.
Тримайте шприц-ручку голкою вгору.
Натисніть і потримайте кнопку дози, поки лічильник дози не повернеться до «0». Значення «0» повинно відповідати покажчику дози. На кінчику голки повинна з’явитися крапля розчину.
На кінчику голки може залишитися невелика крапля, але вона не буде вводитися.
Якщо жодна крапля не з’явилася, поверніться до пункту 2 «Перевірка потоку розчину з нової шприц-ручки» до 6 разів. Якщо краплі все ще немає, змініть голку і повторіть дії, описані у пункті 2 «Перевірка потоку розчину з нової шприц-ручки» ще раз.
Якщо крапля все-таки не з’явилася, утилізуйте ручку і використовуйте нову.
![]() Потрібно завжди переконуватись, що крапля
з’являється на кінчику голки, перш ніж вперше використовувати нову ручку. Це гарантує, що розчин буде введений.
Потрібно завжди переконуватись, що крапля
з’являється на кінчику голки, перш ніж вперше використовувати нову ручку. Це гарантує, що розчин буде введений.
Якщо крапля не з’явиться, не використовуйте шприц-ручку, навіть якщо лічильник дози змінює значення. Це може вказувати на заблоковану або пошкоджену голку.
Якщо Ви не перевірите потік перед першою ін’єкцією нової ручки, то можете не отримати необхідну дозу розчину для забезпечення бажаної дії лікарського засобу Саксенда®.
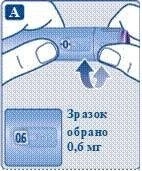
3. Виставлення дози
;Повертайте селектор дози, поки лічильник дози не покаже необхідну дозу (0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг або 3,0 мг).
Якщо Ви вибрали неправильну дозу, можна повернути селектор дози вперед або назад до правильної дози.
Шприц-ручка вміщує максимум 3,0 мг препарату.
За допомогою селектора можна змінити дозу. Тільки лічильник дози та показник дози покажуть, яку кількість міліграмів Ви вибираєте для ін’єкції.
Ви можете вибрати до 3,0 мг лікарського засобу на дозу. Якщо шприц-ручка містить менше 3,0 мг, лічильник дози зупиняється до значення 3,0 мг.
Чути різне клацання селектора дози при обертанні вперед, назад або при виставленні залишкової кількості розчину. Не рахуйте клацання.
![]() Завжди використовуйте лічильник дози та покажчик дози,
щоб побачити, скільки міліграмів Ви вибрали перед введенням цього препарату.
Завжди використовуйте лічильник дози та покажчик дози,
щоб побачити, скільки міліграмів Ви вибрали перед введенням цього препарату.
Не рахуйте кількість клацань шприц-ручки.
Не використовуйте шкалу картриджа. Вона показує приблизну кількість розчину, яка залишилась у шприц-ручці.
За допомогою селектора дози повинні бути виставлені лише дози 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг або 3,0 мг. Цифри на дисплеї повинні точно збігатися з покажчиком дози, щоб забезпечити правильну дозу для введення.
Залишок розчину в шприц-ручці
;Шкала шприц-ручки показує приблизно, скільки розчину залишилось у шприц-ручці.
;Щоб точно побачити, скільки розчину залишилось, скористайтеся лічильником дози:
Повертайте селектор дози вліво, поки лічильник дози не зупиниться.
Якщо він показує 3,0, у шприц-ручці залишилося щонайменше 3,0 мг. Якщо лічильник дози зупиняється до 3,0 мг, значить у шприц-ручці не вистачає розчину для повної дози 3,0 мг.
Якщо Вам потрібна вища доза, ніж та, що залишилася у Вашій шприц-ручці.
Ви можете розділити свою дозу між Вашою поточною шприц-ручкою та новою шприц-ручкою тільки за умови, що Вас проінструктував лікар або медсестра. Використовуйте калькулятор, щоб спланувати дози згідно з інструкціями лікаря або медсестри. Будьте дуже обережні, щоб правильно розрахувати дозу.
Будьте дуже уважні, розраховуючи дозу.
Якщо Ви не впевнені, як розділити дозу за допомогою двох шприц-ручок, виберіть і введіть необхідну дозу новою шприц-ручкою.
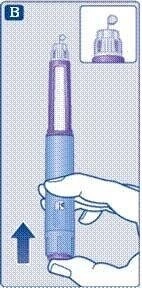
4. Введення дози
;Введіть голку під шкіру так, як показав Вам лікар чи медсестра.
;Переконайтеся, що Ви бачите лічильник дози. Не закривайте лічильник пальцями. Це може перервати ін’єкцію.
Натисніть і утримуйте пускову кнопку. Спостерігайте, поки лічильник дози не повернеться до «0».
«0» повинен збігатися з покажчиком дози. Потім Ви можете почути або відчути клацання.
;Продовжуйте натискати пускову кнопку, утримуючи голку під шкірою.
Рахуйте повільно до 6, утримуючи натиснутою пускову кнопку.
Якщо голку витягти раніше, Ви можете побачити потік розчину з кінчика голки. В такому випадку правильна доза не буде введена.
Витягніть голку з-під шкіри. Після цього можна відпустити пускову кнопку.
Якщо крапля крові з’явилась у місці ін’єкції, легенько притисніть це місце.
Ви можете побачити краплю розчину на кінчику голки після введення. Це нормально і не впливає на об’єм введеної дози.
Завжди дивіться на покажчик дози, щоб бачити скільки міліграмів розчину Ви ввели.
Тримайте натиснутою пускову кнопку, поки покажчик дози не покаже знову «0».
Як виявити заблоковану чи пошкоджену голку?
Якщо «0» не відображається на лічильнику дози після постійного натискання пускової кнопки, можливо, Ви використали заблоковану або пошкоджену голку.
У цьому випадку Ви не ввели потрібну кількість лікарського засобу, навіть незважаючи на те, що лічильник дози перемістився від раніше встановленої дози.
Як поводитися із заблокованою голкою?
Зніміть голку, як описано в пункті 5 «Після ін’єкції» і повторіть дії, описані в усіх пунктах, починаючи з пункту 1 «Підготовка шприц-ручки з новою голкою для використання»
Ніколи не торкайтеся лічильника під час введення лікарського засобу. Це може перервати ін’єкцію.
5. Після ін’єкції
;Завжди утилізуйте голку після кожної ін’єкції, щоб забезпечити зручність ін’єкції та запобігти використанню заблокованої голки. Якщо голка заблокована, Ви не зможете ввести лікарський засіб.
Покладіть зовнішній ковпачок голки на пласку поверхню і надіньте зовнішній ковпачок на голку, не торкаючись голки та зовнішнього ковпачка голки
Як тільки голка накривається, обережно повністю натисніть на зовнішній ковпачок голки.
Обережно викрутіть голку та утилізуйте за інструкціями, отриманими від лікаря, медсестри, фармацевта, або відповідно до місцевих правил.
Закривайте кришкою шприц-ручку після кожного використання, щоб захистити розчин від світла.
Коли ручка порожня, викиньте її без голки за інструкціями, отриманими від лікаря, медсестри, фармацевта, або відповідно до місцевих правил.
Ніколи не намагайтеся надіти внутрішній ковпачок голки назад на голку. Ви можете поранитися голкою.
Завжди виймайте голку з ручки після кожної ін’єкції. Це може запобігти заблокуванню голки, забрудненню, зараженню, протіканню розчину та неточному дозуванню.
Важлива інформація
Завжди тримайте шприц-ручку та голки в недоступному місці для інших людей, особливо дітей.
Ніколи не передавайте Вашу особисту шприц-ручку чи голки іншим людьми.
Люди, що доглядають, мають бути дуже обережними при роботі з використаними голками, щоб запобігти травмуванню голкою та перехресному зараженню.
Догляд за Вашою шприц-ручкою
Не залишайте Вашу шприц-ручку в машині чи іншому місці, де може бути дуже жарко або занадто холодно.
Не вводити лікарський засіб Саксенда®, який був заморожений. У такому разі ви можете не отримати очікуваного лікувального ефекту від цього препарату.
Зберігайте шприц-ручку від пилу, бруду та рідин.
Не мийте, не замочуйте та не змащуйте шприц-ручку. Її можна очистити за допомогою тканини, змоченої м’яким миючим засобом.
Запобігайте падінню та ударам шприц-ручки об тверді поверхні. В разі падіння чи удару приєднайте нову голку і перевірте подачу розчину перед введенням.
Не намагайтеся повторно наповнити шприц-ручку. Утилізуйте шприц-ручку після закінчення в ній розчину.
Не намагайтеся самостійно полагодити шприц-ручку або розібрати її на частини.
У клінічних дослідженнях та протягом постмаркетингового застосування лікарського засобу Саксенда® повідомлялося про випадки передозування до 72 мг (у 24 рази більше рекомендованої підтримуючої дози). Події, про які повідомлялося, включали сильну нудоту, сильне блювання та тяжку гіпоглікемію.
У разі передозування слід розпочати підтримуюче лікування відповідно до наявних у пацієнта клінічних ознак і симптомів. Необхідно спостерігати за станом пацієнта щодо клінічних ознак зневоднення та контролювати рівень глюкози в крові.
Резюме профілю безпеки
Безпека застосування лікарського засобу Саксенда® була оцінена у 5 подвійно сліпих рандомізованих плацебо-контрольованих клінічних дослідженнях за участю 5813 дорослих пацієнтів з ожирінням або надмірною масою тіла із хоча б одним супутнім захворюванням, пов’язаним з надмірною масою тіла. Загалом найбільш частими побічними реакціями були розлади травної системи (67,9 %) (див. розділ «Опис окремих побічних реакцій»).
Список побічних реакцій
Нижче зазначені побічні реакції, про які повідомлялося у дорослих. Побічні реакції класифіковані за системами органів та частотою виникнення. Оцінку частоти виникнення побічних реакцій проводили за такою шкалою: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1000 до < 1/100), рідко (від ≥ 1/10000 до < 1/1000), дуже рідко (< 1/10000) та частота невідома (не можна визначити на основі наявних даних). У кожній групі побічні реакції наведені в порядку зниження їх серйозності.
З боку імунної системи: рідко – анафілактичні реакції.
Порушення метаболізму і харчування: часто – гіпоглікемія*; нечасто – зневоднення.
Психічні розлади: часто – безсоння**.
З боку нервової системи: дуже часто – головний біль; часто – запаморочення, дисгевзія.
З боку серцево-судинної системи: нечасто – тахікардія.
З боку травної системи: дуже часто – нудота, блювання, діарея, запор; часто - сухість у роті, диспепсія, гастрит, гастроезофагеальна рефлюксна хвороба, біль у верхньому відділі черевної порожнини, метеоризм, еруктація, здуття живота; нечасто – панкреатит***, затримка випорожнення шлунка****; частота невідома – кишкова непрохідність†.
З боку печінки та жовчних шляхів: часто – жовчнокам’яна хвороба***; нечасто – холецистит***.
З боку шкіри та підшкірних тканин: часто – висип, нечасто – кропив’янка, невідомо – амілоїдоз шкіри.
З боку нирок та сечовивідних шляхів: рідко – гостра ниркова недостатність, порушення функції нирок.
Загальні розлади та реакції в місці ін’єкції: часто – реакції в місцях ін’єкцій, астенія, втома; нечасто – нездужання.
Лабораторні дослідження: часто – підвищений рівень ліпази, підвищений рівень амілази.
* Гіпоглікемія (базується на симптомах, про які повідомляли самі пацієнти і які не підтверджені вимірюваннями рівня глюкози в крові) виникала у пацієнтів, які не страждають на цукровий діабет 2 типу та які застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю. Для отримання додаткової інформації див. розділ «Опис окремих побічних реакцій».
** Безсоння, в основному спостерігалося протягом перших 3 місяців лікування.
*** Див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій».
**** З контрольованої фази 2, За та Зб клінічних досліджень.
† Побічні реакції, відомі з постмаркетингового досвіду.
окремих побічних реакцій
Гіпоглікемія в пацієнтів, які не страждають на цукровий діабет 2 типу
У процесі клінічних випробувань не було зафіксованого жодного тяжкого випадку виникнення гіпоглікемії (що потребує сторонньої допомоги) у пацієнтів з надмірною масою тіла чи ожирінням, які не страждали на цукровий діабет 2 типу та застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю. Про виникнення симптомів гіпоглікемії повідомили 1,6 % пацієнтів, які отримували лікарський засіб Саксенда®, та 1,1 % пацієнтів, які отримували плацебо. Однак ці випадки не були підтверджені вимірюванням рівня глюкози в крові. Більшість випадків легко переносились.
Гіпоглікемія у хворих на цукровий діабет 2 типу
У клінічному досліджені були повідомлення про випадки тяжкої гіпоглікемії у 0,7 % пацієнтів з надмірною масою тіла чи ожирінням, які страждали на цукровий діабет 2 типу й застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю та які застосовували сульфонілсечовину. Також зафіксовано виникнення симптомів гіпоглікемії у 43,6 % пацієнтів, які застосовували лікарський засіб Саксенда®, та у 27,3 % пацієнтів, які отримували плацебо. Серед пацієнтів, які не застосовували сульфонілсечовину, було зафіксовано виникнення симптомів гіпоглікемії (визначаються концентрацією глюкози у плазмі крові ≤ 3,9 ммоль/л) у 15,7 % пацієнтів, які отримували лікарський засіб Саксенда®, та у 7,6 % пацієнтів, які отримували плацебо.
Гіпоглікемія у хворих на цукровий діабет 2 типу, які отримують інсулін
У процесі клінічного дослідження були повідомлення про випадки тяжкої гіпоглікемії (що потребує сторонньої допомоги) у 1,5 % пацієнтів з надмірною масою тіла чи ожирінням, які страждали на цукровий діабет 2 типу та застосовували інсулін та ліраглутид в дозі 3,0 мг/добу у поєднанні з дієтою та фізичною активністю і застосуванням до 2 пероральних протидіабетичних препаратів. В цьому дослідженні було зафіксовано виникнення симптоматичної гіпоглікемії (визначена як рівень глюкози в плазмі крові ≤ 3,9 ммоль/л, що супроводжується симптомами) у 47,2 % пацієнтів, які отримували ліраглутид у дозі 3,0 мг/добу, та у 51,8 % пацієнтів, які отримували плацебо. Серед пацієнтів, які застосовували сульфонілсечовину, були зафіксовані повідомлення про виникнення симптомів гіпоглікемії у 60,9 % пацієнтів, які отримували ліраглутид 3,0 мг/добу, та у 60,0 % пацієнтів, які отримували плацебо.
Розлади травної системи
Більшість випадків виникнення розладів травної системи були легкого або помірного ступеня тяжкості та не призводили до припинення терапії. Зазвичай реакції виникали протягом перших тижнів лікування і зменшувались протягом декількох днів або тижнів при продовженні лікування.
У пацієнтів віком від 65 років при застосуванні лікарського засобу Саксенда® частіше спостерігатися порушення з боку травної системи.
У пацієнтів з порушеннями функції нирок легкої або середньої тяжкості (кліренс креатиніну ≥ 30 мл/хв) при застосуванні лікарського засобу Саксенда® можуть частіше виникати порушення з боку травної системи.
Гостра ниркова недостатність
Зафіксовано випадки виникнення гострої ниркової недостатності у пацієнтів, які застосовували агоністи рецепторів ГПП-1. Більшість зареєстрованих випадків спостерігали у пацієнтів, які страждали на нудоту, блювання та діарею, що і призводило до втрати рідини (див. розділ «Особливості застосування»).
Алергічні реакції
Були повідомлення про кілька випадків виникнення анафілактичних реакцій, що супроводжувались такими симптомами як гіпотензія, підвищене серцебиття, напади задухи та набряки після застосування ліраглутиду. Анафілактичні реакції можуть бути небезпечними для життя. Тому якщо є підозра на виникнення анафілактичної реакції, слід припинити застосування ліраглутиду (див. розділ «Протипоказання»).
Реакції в місці ін’єкції
Повідомлялось про реакції в місці введення лікарського засобу Саксенда®. Ці реакції зазвичай були легкими, більшість із них зникали в процесі подальшого лікування.
Тахікардія
У процесі клінічних досліджень були повідомлення про випадки тахікардії у 0,6 % пацієнтів, які отримували лікарський засіб Саксенда®, та у 0,1 % пацієнтів, які отримували плацебо. Більшість випадків були легкого або помірного ступеня тяжкості. Випадки були поодинокими, більшість із них зникали в процесі подальшого лікування.
Амілоїдоз шкіри
Амілоїдоз шкіри може виникнути в місці ін'єкції (див. розділ «Спосіб застосування та дози»).
30 місяців.
Дату завершення терміну придатності зазначено на маркуванні шприц-ручки та картонній упаковці після слів «Придатн. до».
Після першого застосування – 1 місяць.
Зберігати в недоступному для дітей місці.
Зберігати в холодильнику (2–8 °С) подалі від морозильної камери.
Після першого застосування зберігати при температурі нижче 30 °С або в холодильнику
(2–8 °С). Не заморожувати.
Для запобігання дії світла зберігати шприц-ручку із закритим ковпачком.
Несумісність
Додавання до лікарського засобу Саксенда® будь-якої субстанції може призвести до деградації ліраглутиду. Оскільки дослідження сумісності не проводилися, цей лікарський засіб не можна застосовувати з іншими лікарськими засобами.
Попередньо заповнена багатодозова одноразова шприц-ручка, виготовлена з поліпропілену, поліацеталу, полікарбонату та акрилонітрилу бутадієну стиролу, містить картридж (скло типу I) разом із поршнем (бромбутил) та ламіновану гумову прокладку (бромбулит/поліізопрен).
Кожна шприц-ручка містить 3 мл розчину, що дає можливість ввести дози по 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг та 3,0 мг.
Упаковка містить 1, 3 або 5 попередньо заповнених шприц-ручок.
За рецептом.
А/Т Ново Нордіск.
Місцезнаходження заявника/виробника та адреса місця провадження його діяльності.
Ново Аллє
2880, Багсваерд
Данія.
Увага! Інструкція до препарату на сайті має інформаційне значення. Перед застосуванням ознайомтесь з інструкцією виробника!
діюча речовина: ліраглутид;
1 мл розчину містить 6 мг ліраглутиду – аналога людського глюкагоноподібного пептиду-1 (ГПП-1), виготовленого за технологією рекомбінантної ДНК в Saccharomyces cerevisiae;
одна попередньо заповнена шприц-ручка містить 18 мг ліраглутиду в 3 мл;
допоміжні речовини: натрію гідрофосфат, дигідрат; пропіленгліколь; фенол; кислота хлористоводнева (для корекції рН); натрію гідроксид (для корекції рН); вода для ін’єкцій.
Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий та безбарвний або майже безбарвний ізотонічний розчин; рН=8,15.
Препарати, що застосовуються при цукровому діабеті, аналоги глюкагоноподібного пептиду-1 (ГПП-1). Код ATХ A10B J02.
Фармакодинаміка.
Ліраглутид є ацильованим аналогом ГПП-1 з послідовністю амінокислот на 97 % гомологічною ендогенному людському ГПП-1. Ліраглутид зв’язується з ГПП-1-рецепторами та активує їх.
ГПП-1 є фізіологічним регулятором апетиту та споживання їжі, але точний механізм його дії повністю не встановлений. У дослідженнях на тваринах периферійне введення ліраглутиду призвело до його накопичення в специфічних ділянках мозку, що відповідають за регуляцію апетиту, де ліраглутид завдяки специфічній активації рецепторів ГПП-1 підвищував відчуття насичення і знижував сигнали голоду, що сприяло зниженню маси тіла.
Рецептори ГПП-1 також експресуються у певних ділянках серця, судин, імунній системі та нирках. При моделюванні атеросклерозу у мишей ліраглутид запобігав прогресуванню аортальної атеросклеротичної бляшки та знижував запалення в бляшці. Крім того, ліраглутид позитивно впливав на ліпіди плазми. Ліраглутид не зменшував розмір вже наявних атеросклеротичних бляшок.
Фармакодинамічні ефекти
Ліраглутид знижує масу тіла у людей головним чином за рахунок втрати жирової маси, при цьому завдяки зменшенню переважно вісцерального жиру порівняно з підшкірним. Ліраглутид регулює апетит, підсилюючи відчуття ситості та наповненості шлунка, знижуючи при цьому відчуття голоду, та призводить до зниження споживання їжі. Ліраглутид не збільшує енерговитрати порівняно з плацебо.
Ліраглутид стимулює секрецію інсуліну та зменшує надмірно високу секрецію глюкагону залежно від рівня глюкози, що призводить до зниження глюкози натще та після вживання їжі.
У пацієнтів з переддіабетом та цукровим діабетом ефект зниження рівня глюкози більш виражений, порівняно з пацієнтами з нормоглікемією. Клінічні випробування свідчать, що ліраглутид покращує та підтримує функцію бета-клітин відповідно до НОМА-В та співвідношення проінсулін/інсулін.
Клінічна ефективність та безпека
Клінічна ефективність та безпека ліраглутиду при застосуванні для зниження маси тіла як доповнення до дієти зі зниженою калорійністю та збільшеною фізичною активністю були вивчені у чотирьох рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях фази 3 за участі 5358 пацієнтів.
Дослідження 1 (SCALE Ожиріння та переддіабет – 1839):
Всього 3731 пацієнт із ожирінням (індекс маси тіла (ІМТ) ≥30 кг/м2) або з надмірною масою тіла (ІМТ ≥27 кг/м2) і дисліпідемією та/або артеріальною гіпертензією були стратифіковані за допомогою скринінгу відповідно до статусу переддіабету та початкового рівня ІМТ (≥ 30 кг/м2 або <30 кг/м2). Всі пацієнти (3731) були рандомізовані на лікування протягом 56 тижнів, а 2254 пацієнти, які мали переддіабет на момент скринінгу, були рандомізовані на лікування протягом 160 тижнів. Обидва періоди лікування супроводжувались 12-тижневим періодом спостереження за групами препарат/плацебо. Корекція способу життя у вигляді дієти зі зниженою калорійністю та збільшеною фізичною активністю була базовою терапією для всіх пацієнтів.
У 56-тижневому дослідженні 1 оцінювали зниження маси тіла у всіх (3731) рандомізованих пацієнтів (2590 пацієнтів завершили курс лікування).
У 160-тижневому дослідженні 1 оцінювали час до розвитку цукрового діабету 2 типу у 2254 рандомізованих пацієнтів з переддіабетом (1128 пацієнтів завершили курс лікування).
Дослідження 2 (SCALE Діабет – 1922):
Дослідження тривалістю 56 тижнів, у якому оцінювали зниження маси тіла у 846 рандомізованих пацієнтів із ожирінням та надмірною масою тіла (628 пацієнтів завершили курс лікування), які мали недостатньо контрольований цукровий діабет 2 типу (HbA1c в діапазоні 7–10 %). Основним методом лікування на початку дослідження була або дієта, або збільшена фізична активність, або застосування окремих лікарських засобів, таких як метформін, сульфонілсечовина та глітазон, або їх комбінацій.
Дослідження 3 (SCALE Апное під час сну – 3970):
Дослідження тривалістю 32 тижні, в якому оцінювали ступінь тяжкості апное під час сну та зниження маси тіла у 359 рандомізованих пацієнтів (276 пацієнтів завершили курс лікування) з ожирінням та обструктивним апное під час сну середнього або тяжкого ступеня.
Дослідження 4 (SCALE Підтримуюче лікування - 1923):
У дослідженні тривалістю 56 тижнів оцінювали підтримуюче лікування після зменшення маси тіла ≥5 %, спричиненого дієтою зі зниженою калорійністю, у 422 рандомізованих пацієнтів із ожирінням та надмірною масою тіла (305 пацієнтів завершили курс лікування) і артеріальною гіпертензією чи дисліпідемією.
Маса тіла
При застосуванні ліраглутиду було досягнуто кращого зниження маси тіла порівняно з плацебо у пацієнтів із ожирінням та надмірною масою тіла у всіх досліджуваних групах. У всіх популяціях дослідження більша частина пацієнтів досягала зниження маси тіла на ≥5 % та >10 % при застосуванні ліраглутиду порівняно з плацебо (таблиці 1–3). У 160-тижневій частині дослідження 1 зниження маси тіла відбувалося переважно в перший рік терапії і підтримувалося протягом всіх 160 тижнів.
У дослідженні 4 при застосуванні ліраглутиду більше пацієнтів утримували результат зниження маси тіла, досягнутий до початку лікування, порівняно з плацебо (81,4 % та 48,9 % відповідно). Конкретні дані досліджень 1–4 щодо зниження маси тіла, терміну лікування та кумулятивного розподілу зміни маси тіла (%) представлені в таблицях 1–5 і на рисунках 1, 2 і 3.
Зниження маси тіла через 12 тижнів при лікуванні ліраглутидом (3,0 мг)
Особами, які мали ранню відповідь на лікування, були пацієнти, які досягли ≥ 5 % зниження маси тіла після 12 тижнів застосування терапевтичної дози ліраглутиду (4 тижні ескалації дози та 12 тижнів прийому лікувальної дози). У дослідженні 1 тривалістю 56 тижнів 67,5 % пацієнтів досягли ≥ 5 % зниження маси тіла після 12 тижнів. У дослідженні 2 50,4 % пацієнтів досягли зниження маси тіла ≥ 5 % через 12 тижнів. При продовженні лікування прогнозується, що 86,2 % пацієнтів досягнуть зниження маси тіла ≥ 5 %, а 51 % пацієнтів – ≥ 10 % після застосування ліраглутиду протягом року. Середнє зниження маси тіла у пацієнтів, які застосовували ліраглутид протягом року, становила 11,2 % від їх початкової маси тіла (9,7 % для чоловіків і 11,6 % для жінок). Серед пацієнтів, які досягли < 5 % зниження маси тіла після 12 тижнів терапії, частка пацієнтів, які після року застосування ліраглутиду не досягли зменшення маси тіла ≥ 10 %, становила 93,4 %.
Контроль глікемії
Лікування ліраглутидом значно покращило показники глікемії у пацієнтів з нормоглікемією, переддіабетом та цукровим діабетом 2 типу. У 56-тижневій частині дослідження 1 цукровий діабет 2 типу розвинувся у меншої кількості пацієнтів, які отримували ліраглутид, порівняно з пацієнтами, які отримували плацебо (0,2 % проти 1,1 % відповідно). У більшості пацієнтів з переддіабетом на початку лікування спостерігався зворотний розвиток даного захворювання після застосування ліраглутиду порівняно з плацебо (69,2 % проти 32,7 % відповідно). Первинною кінцевою точкою ефективності у 160-тижневій частині дослідження 1 була частка пацієнтів, у яких виник цукровий діабет 2 типу, оцінена як час до розвитку цукрового діабету. На 160-му тижні дослідження у 3 % пацієнтів, які отримували лікарський засіб Саксенда®, і в 11 % пацієнтів, які отримували плацебо, діагностували цукровий діабет 2 типу. Розрахунковий час розвитку цукрового діабету 2 типу у пацієнтів, які отримували ліраглутид 3 мг, був у 2,7 раза довший (95 % ДІ [1,9; 3,9]), а коефіцієнт ризику розвитку цукрового діабету 2 типу становив 0,2 для ліраглутиду порівняно з плацебо.
Кардіометаболічні фактори ризику
Лікування ліраглутидом значно покращило показники систолічного артеріального тиску та окружності талії порівняно з плацебо (таблиці 1, 2 та 3).
Індекс апное-гіпное (ІАГ)
При застосуванні ліраглутиду спостерігалось значне зниження тяжкості обструктивного апное під час сну порівняно з плацебо, яке було оцінене за допомогою зменшення порівняно з плацебо (таблиця 4).
Таблиця 1
Дослідження 1: зміни маси тіла, глікемії та кардіометаболічних показників на 56-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда® (N = 2437)
Плацебо (N = 1225)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
106,3 (21,2)
106,3 (21,7)
-
Середня зміна на 56-му тижні, % (95 % ДІ)
8,0
2,6
5,4** (–5,8; –5,0)
Середня зміна на 56-му тижні, кг (95 % ДІ)
8,4
2,8
5,6** (–6,0; –5,1)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ)
63,5
26,6
4,8** (4,1; 5,6)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ)
32,8
10,1
4,3** (3,5; 5,3)
Глікемія та кардіометаболічні фактори
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
HbA1c, %
5,6
0,3
5,6
0,1
0,23**
(–0,25; –0,21)
ГПН, ммоль/л
5,3
0,4
5,3
0,01
0,38**
(–0,42; –0,35)
Систолічний артеріальний тиск, мм рт. ст.
123,0
4,3
123,3
1,5
2,8** (–3,6; –2,1)
Діастолічний артеріальний тиск, мм рт. ст.
78,7
2,7
78,9
1,8
0,9* (–1,4; –0,4)
Окружність талії, см
115,0
8,2
114,5
4,0
4,2** (–4,7; –3,7)
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 2
Дослідження 1: зміни маси тіла, глікемії та кардіометаболічних показників на 160-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда®
(N = 1472)
Плацебо (N = 738)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
107,6 (21,6)
108,0 (21,8)
Середня зміна на 160-му тижні, % (95 % ДІ)
6,2
1,8
4,3**
(–4,9; –3,7)
Середня зміна на 160-му тижні, кг (95 % ДІ)
6,5
2,0
4,6**
(–5,3; –3,9)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 160-му тижні, % (95 % ДІ)
49,6
23,4
3,2**
(2,6; 3,9)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 160-му тижні, % (95 % ДІ)
24,4
9,5
3,1**
(2,3; 4,1)
Глікемія та кардіометаболічні фактори
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
HbA1c, %
5,8
0,4
5,7
0,1
0,21**
(–0,24; –0,18)
ГПН, ммоль/л
5,5
0,4
5,5
0,04
0,4**
(–0,5; –0,4)
Систолічний артеріальний тиск, мм рт. ст.
124,8
3,2
125,0
0,4
2,8**
(–3,8; –1,8)
Діастолічний артеріальний тиск, мм рт. ст.
79,4
2,4
79,8
1,7
0,6 (–1,3; 0,1)
Окружність талії, см
116,6
6,9
116,7
3,4
3,5**
(–4,2; –2,8)
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 160-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 160-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 3
Дослідження 2: зміни маси тіла, глікемії та кардіометаболічних показників на 56-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда® (N = 412)
Плацебо (N = 211)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
105,6 (21,9)
106,7 (21,2)
-
Середня зміна на 56-му тижні, % (95 % ДІ)
5,9
2,0
4,0** (–4,8; –3,1)
Середня зміна на 56-му тижні, кг (95 % ДІ)
6,2
2,2
4,1** (–5,0; –3,1)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ)
49,8
13,5
6,4** (4,1; 10,0)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ)
22,9
4,2
6,8** (3,4; 13,8)
Глікемія та кардіометаболічні фактори
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
HbA1c, %
7,9
1,3
7,9
0,4
0,9** (–1,1; –0,8)
ГПН, ммоль/л
8,8
1,9
8,6
0,1
1,8** (–2,1; –1,4)
Систолічний артеріальний тиск, мм рт. ст.
128,9
3,0
129,2
0,4
2,6* (–4,6; –0,6)
Діастолічний артеріальний тиск, мм рт. ст.
79,0
1,0
79,3
0,6
0,4 (–1,7; 1,0)
Окружність талії, см
118,1
6,0
117,3
2,8
3,2** (–4,2; –2,2)
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 4
Дослідження 3: зміни маси тіла та індексу апное-гіпопное на 32-му тижні порівняно з вихідними величинами
Маса тіла
Саксенда® (N = 180)
Плацебо (N = 179)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
116,5 (23,0)
118,7 (25,4)
-
Середня зміна на 32-му тижні, % (95 % ДІ)
5,7
1,6
4,2** (–5,2; –3,1)
Середня зміна на 32-му тижні, кг (95 % ДІ)
6,8
1,8
4,9** (–6,2; –3,7)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 32-му тижні, % (95 % ДІ)
46,4
18,1
3,9** (2,4; 6,4)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 32-му тижні, % (95 % ДІ)
22,4
1,5
19,0** (5,7; 63,1)
Вихідний показник на візиті включення
Зміна
Вихідний показник на візиті включення
Зміна
Індекс апное-гіпопное, епізодів/годину
49,0
12,2
49,3
6,1
6,1* (–11,0; –1,2)
Повна вибірка пацієнтів. Для вихідних показників наведено середні величини, зміни на 32-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 32-му тижні є розрахунковими різницями між методами лікування (95 % ДІ). Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
СВ — стандартне відхилення.
Таблиця 5
Дослідження 4: зміна маси тіла на 56-му тижні порівняно з вихідною величиною
Маса тіла
Саксенда® (N = 207)
Плацебо (N = 206)
Саксенда® порівняно з плацебо
Вихідна маса тіла на візиті включення, кг (СВ)
100,7 (20,8)
98,9 (21,2)
-
Середня зміна на тижні 56, % (95 % ДІ)
6,3
0,2
6,1** (–7,5; –4,6)
Середня зміна на 56-му тижні, кг (95 % ДІ)
6,0
0,2
5,9** (–7,3; –4,4)
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ)
50,7
21,3
3,8** (2,4; 6,0)
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ)
27,4
6,8
5,1** (2,7; 9,7)
Повна вибірка пацієнтів. Для вихідних показників наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
** p < 0,0001.
ДІ – довірчий інтервал.
СВ – стандартне відхилення.
Зміна маси тіла (%)
Час, у тижнях
□ Саксенда® ∆Плацебо ■▲ Перенос даних останнього дослідження
Значення для пацієнтів, які завершують кожен плановий візит
Рисунок 3. Зміна маси тіла (%) від рандомізації (тиждень 0) за часом у дослідженні 4
До тижня 0 пацієнтів лікували лише за допомогою дієти зі зниженою калорійністю та фізичних вправ. На тижні 0 пацієнти були рандомізовані для застосування або лікарського засобу Саксенда®, або плацебо.
Імуногенність
Враховуючи потенційні імуногенні властивості лікарських засобів, що містять білки або пептиди, можна передбачити, що в пацієнтів можуть утворитися антитіла до ліраглутиду після застосування лікарського засобу Саксенда®. Під час клінічних досліджень у 2,5 % пацієнтів, які отримували ліраглутид, утворювались антитіла до ліраглутиду. Утворення антитіл не призводило до зниження ефективності ліраглутиду.
Вплив на серцево-судинну систему
Основні серйозні несприятливі серцево-судинні явища (МАСЕ), які були визначені зовнішньою незалежною експертною групою: нелетальний інфаркт міокарда, нелетальний інсульт, серцево-судинна смерть. В усіх тривалих клінічних дослідженнях лікарського засобу Саксенда® було зареєстровано 6 МАСЕ у пацієнтів, які отримували ліраглутид, та 10 МАСЕ у пацієнтів, які отримували плацебо. Відношення ризиків та ДІ 95 % при порівнянні лікарського засобу Саксенда® та плацебо становило 0,33 [0,12; 0,90].
У клінічних дослідженнях 3-ї фази спостерігалось підвищення частоти серцевих скорочень порівняно з вихідним значенням в середньому на 2,5 удара за хвилину (від 1,6 до 3,6 удара за хвилину в окремих дослідженнях). Максимальне збільшення частоти серцевих скорочень спостерігалося приблизно після 6 тижнів терапії. Тривалий клінічний вплив збільшення частоти серцевих скорочень не встановлений. Це збільшення було зворотним та зникало після припинення терапії ліраглутидом (див. розділ «Особливості застосування»).
У дослідженні LEADER® брали участь 9340 пацієнтів із недостатньо контрольованим цукровим діабетом 2 типу. Переважна кількість із них страждали на серцево-судинні захворювання. Пацієнтів рандомізовано розподіляли для застосування ліраглутиду у добовій дозі до 1,8 мг (4668) або плацебо (4672) на додаток до стандартного лікування.
Тривалість терапії становила від 3,5 до 5 років. Середній вік пацієнтів становив 64 роки, середній ІМТ – 32,5 кг/м². Середнє значення початкового рівня HbA1c становило 8,7 і покращилося через 3 роки на 1,2 % у пацієнтів, яким був призначений ліраглутид, та на 0,8 % у пацієнтів, яким було призначено плацебо. Первинною кінцевою точкою ефективності був час від рандомізації до першого виникнення будь-яких основних MACE: нелетального інфаркту міокарда, нелетального інсульту, серцево-судинної смерті. Ліраглутид значно знизив частоту виникнення основних несприятливих серцево-судинних явищ (події первинної кінцевої точки, MACE) порівняно з плацебо (3,41 проти 3,90 на 100 пацієнто-років у групах ліраглутиду та плацебо відповідно), зменшивши ризик на 13 %, відношення ризиків (HR) – 0,87, [0,78; 0,97] [95 % ДІ]) (р = 0,005) (див. Рисунок 4).
Пацієнти з подією (%)
Час від рандомізації (місяці)
HR: 0,87
95 % ДІ 0,78; 0,97;
р<0,001 для не меншої
ефективності;
р=0,005 для вищої ефективності
- - - - - - плацебо
ліраглутид
Пацієнтів у групі ризику
Плацебо
4672
4587
4473
4352
4237
4123
4010
3914
1543
407
Ліраглутид
4668
4593
4496
4400
4280
4172
4072
3982
1562
424
FAS: Повний набір аналізів
Рисунок 4. Графік Каплана — Маєра час до першої події MACE — популяція FAS
Подвійно сліпе дослідження ефективності і безпеки застосування лікарського засобу Саксенда® порівняно з плацебо для зниження маси тіла у пацієнтів дитячого віку від 12 років з ожирінням показало, що лікарський засіб Саксенда® є більш ефективним, ніж плацебо, для зниження маси тіла (яке оцінювалось за шкалою стандартного відхилення ІМТ або Z-score) через 56 тижнів лікування (табл. 6).
Серед пацієнтів, які приймали ліраглутид, більший відсоток пацієнтів досяг зниження ІМТ на ≥ 5 % та ≥ 10 %, ніж серед пацієнтів, які приймали плацебо. В середньому зниження ІМТ та маси тіла також було більшим у групі пацієнтів, які приймали ліраглутид (табл. 6). Після 26 тижнів періоду подальшого спостереження без застосування досліджуваного лікарського засобу спостерігалося відновлення маси тіла у пацієнтів, які приймали ліраглутид, порівняно з тими, хто приймав плацебо (табл. 6).
Таблиця 6
Дослідження 4180: зміни від вихідного рівня маси тіла та ІМТ на 56-му тижні та зміна за шкалою стандартного відхилення ІМТ (BMI SDS) від 56-го тижня до 82-го тижня
Саксенда® (N=125)
Плацебо (N=126)
Саксенда® порівняно з плацебо
BMI SDS
Вихідний показник, BMI SDS (СВ)
3,14 (0,65)
3,20 (0,77)
Середня зміна на 56-му тижні
(95 % ДІ)
0,23
0,00
0,22* (-0,37; -0,08)
56-й тиждень, BMI SDS (СВ)
2,88 (0,94)
3,14 (0,98)
Середня зміна від 56-го тижня до 82-го тижня, BMI SDS (95 % ДІ)
0,22
0,07
0,15** (0,07; 0,23)
Маса тіла
Вихідний показник, кг (СВ)
99,3 (19,7)
102,2 (21,6)
-
Середня зміна на 56-му тижні, % (95 % ДІ)
2,65
2,37
5,01** (-7,63; -2,39)
Середня зміна на 56-му тижні, кг (95 % ДІ)
2,26
2,25
4,50** (-7,17; -1,84)
ІМТ
Вихідний показник, кг/м2 (СВ)
35,3 (5,1)
35,8 (5,7)
-
Середня зміна на 56-му тижні, кг/м2 (95 % ДІ)
1,39
0,19
1,58** (-2,47; -0,69)
Відсоток пацієнтів зі зниженням на ≥ 5 % вихідного ІМТ на 56-му тижні, % (95 % ДІ)
43,25
18,73
3,31** (1,78; 6,16)
Відсоток пацієнтів зі зниженням на ≥ 10 % вихідного ІМТ на
56-му тижні, % (95 % ДІ)
26,08
8,11
4,00** (1,81; 8,83)
Повна вибірка пацієнтів. Для BMI SDS, маси тіла та ІМТ вихідні показники є середніми величинами, зміни від вихідного рівня на 56-му тижні є розрахованими середніми величинами (методом найменших квадратів), а відмінності в лікуванні на 56-му тижні – це розраховані різниці між методами лікування. Для BMI SDS показники на 56-му тижні є середніми величинами, зміни від 56-го тижня до 82-го тижня є розрахованими величинами (методом найменших квадратів), а відмінності в лікуванні на 82-му тижні – це розраховані різниці між методами лікування. Для частки пацієнтів, які втратили ≥ 5 % / ≥ 10 % вихідного ІМТ, також наведено розраховане співвідношення шансів. Пропущені спостереження інтерпольовані з групи пацієнтів, які приймали плацебо, на основі переходу до референційного підходу множинної (x100) підстановки даних.
* p < 0,01, ** p < 0,001. ДІ – довірчий інтервал. СВ – стандартне відхилення.
Відповідно до переносимості лікарського засобу 103 пацієнти (82,4 %) збільшили дозу та продовжували приймати дозу 3,0 мг, 11 пацієнтів (8,8 %) збільшили дозу та продовжували приймати дозу 2,4 мг, 4 пацієнти (3,2 %) збільшили дозу та продовжували приймати дозу 1,8 мг, 4 пацієнти (3,2 %) збільшили дозу та продовжували приймати дозу 1,2 мг і 3 пацієнти (2,4 %) продовжували приймати дозу 0,6 мг.
Через 56 тижнів лікування не було зареєстровано жодного впливу на ріст чи статеве дозрівання пацієнтів.
Дослідження з 16-тижневим подвійно сліпим періодом і 36-тижневим відкритим періодом було проведено для оцінки ефективності та безпеки застосування лікарського засобу Саксенда® педіатричним пацієнтам із синдромом Прадера – Віллі та ожирінням. Дослідження включало 32 пацієнти віком від 12 до 18 років (частина А) та 24 пацієнти віком від 6 до 12 років (частина В). Пацієнти були рандомізовані в співвідношенні 2:1 для прийому лікарського засобу Саксенда® або плацебо. Пацієнти з масою тіла менше 45 кг почали збільшувати дозу на меншу величину (0,3 мг замість 0,6 мг) та збільшували до максимальної дози 2,4 мг.
Розрахована різниця в лікуванні за середніми значеннями ІМТ SDS на 16 тижні (частина A: -0,20 проти -0,13, частина B: -0,50 проти -0,44) і на 52 тижні (частина A: -0,31 проти -0,17, частина B: -0,73 проти - 0,67) була подібною при застосуванні лікарського засобу Саксенда® та плацебо.
Жодних додаткових проблем щодо безпеки під час дослідження не було помічено.
Європейське агентство з лікарських засобів відклало зобов'язання подавати результати досліджень застосування лікарського засобу Саксенда® в одній або декількох підгрупах дитячого населення при лікуванні ожиріння та при лікуванні синдрому Прадера-Віллі (див. Розділ «Спосіб застосування та дози»).
Фармакокінетика.
Абсорбція
Абсорбція ліраглутиду після підшкірного введення відбувається повільно, максимальна концентрація досягається приблизно через 11 годин після введення. У пацієнтів, які страждають на ожиріння (ІМТ 30-40 кг/м2), після введення 3 мг ліраглутиду його середня рівноважна концентрація (AUCt/24) досягала приблизно 31 нмоль/л. Експозиція ліраглутиду збільшувалася пропорційно дозі. Абсолютна біодоступність ліраглутиду після підшкірного введення становить приблизно 55 %.
Розподіл
Середній видимий об’єм розподілу після підшкірного введення становить 20–25 л (для людини з масою тіла приблизно 100 кг). Ліраглутид значною мірою зв’язується з білками плазми крові (>98 %).
Метаболізм
Протягом 24 годин після введення разової дози [3H]-ліраглутиду здоровим добровольцям основним компонентом у плазмі крові був незмінений ліраглутид. У плазмі крові були виявлені в незначній кількості два метаболіти (≤ 9 % і ≤ 5 % від загального рівня радіоактивності у плазмі крові).
Виведення
Ліраглутид ендогенно метаболізується, як і всі великі білки, без участі специфічного органу як основного шляху елімінації. Після введення дози [3H]-ліраглутиду в сечі і калі не було виявлено незміненого ліраглутиду. Тільки невелика частка введеної радіоактивності у вигляді метаболітів ліраглутиду виводилась нирками та через кишечник (6 % і 5 % відповідно). Радіоактивні речовини виводяться нирками або через кишечник в основному протягом перших 6 – 8 діб у вигляді трьох метаболітів.
Після одноразового підшкірного введення ліраглутиду середнє значення кліренсу становить приблизно 0,9-1,4 л/годину, період напіввиведення – приблизно 13 годин.
Особливі групи пацієнтів
Пацієнти літнього віку
На підставі даних фармакокінетичного аналізу групи пацієнтів віком від 18 до 82 років з надмірною масою тіла чи ожирінням був зроблений висновок, що вік не має клінічно значущого впливу на фармакокінетику ліраглутиду. Тому немає необхідності в коригуванні дози відносно віку.
Стать
Дані фармакокінетичного аналізу показали, що у жінок спостерігається на 24 % нижчий кліренс ліраглутиду порівняно з чоловіками. На підставі цих даних можна зробити висновок, що корекція дози відносно статі не потрібна.
Етнічне походження
На підставі даних фармакокінетичного аналізу групи пацієнтів європеоїдної, монголоїдної, латиноамериканської і негроїдної рас з надмірною масою тіла чи ожирінням був зроблений висновок, що етнічне походження не виявляє будь-якого істотного клінічного впливу на фармакокінетику ліраглутиду.
Маса тіла
Експозиція ліраглутиду зменшується зі збільшенням початкової маси тіла. Як показали дослідження, добова доза ліраглутиду 3,0 мг забезпечує нормальний системний вплив на організм пацієнта з масою тіла 60-234 кг. Експозиція ліраглутиду у пацієнтів з масою тіла більше 234 кг не вивчалась.
Порушення функції печінки
Фармакокінетику ліраглутиду досліджували у пацієнтів із різним ступенем порушень функції печінки у процесі дослідження із застосуванням одноразової дози (0,75 мг). Було показано, що у пацієнтів з легкими і помірними порушеннями функції печінки експозиція ліраглутиду знижувалася на 13-23 % порівняно зі здоровими добровольцями. У пацієнтів з тяжкими порушеннями функції печінки (>9 балів за класифікацією Чайлда – П’ю) експозиція була значно нижча (на 44 %).
Порушення функції нирок
Експозиція ліраглутиду була знижена у пацієнтів з порушеннями функції нирок порівняно з особами з нормальною функцією нирок у процесі дослідження із застосуванням одноразової дози (0,75 мг). У пацієнтів з легкими порушеннями (кліренс креатиніну 50-80 мл/хв) експозиція знижувалася на 33 %, з порушеннями помірної тяжкості (кліренс креатиніну 30 – 50 мл/хв) – на 14 %, з тяжкими порушеннями (кліренс креатиніну <30 мл/хв) – на 27 %, а на кінцевих стадіях захворювань нирок, що вимагають проведення діалізу, – на 26 %.
Діти
Фармакокінетичні властивості ліраглутиду в дозі 3,0 мг було оцінено в ході клінічних досліджень за участю пацієнтів дитячого віку ≥ 12 років з ожирінням (134 пацієнти з масою тіла 62–178 кг).
Експозиція ліраглутиду у дітей ≥ 12 років була подібною до експозиції у дорослих з ожирінням.
Фармакокінетичні властивості також оцінювали у ході клініко-фармакологічного дослідження за участю пацієнтів дитячого віку 7–11 років з ожирінням (13 пацієнтів, маса тіла 54–87 кг) .
Було виявлено порівнянну експозицію при введенні 3,0 мг ліраглутиду у дорослих, дітей ≥ 12 років та дітей віком 7-11 років після корекції маси тіла.
Доклінічні дані з безпеки
Доклінічні дані, що базуються на дослідженнях з фармакологічної безпеки, токсичності повторних доз та генотоксичності, не виявили жодного ризику для людини.
У процесі дворічних досліджень канцерогенності у щурів та мишей були виявлені пухлини С-клітин щитоподібної залози, що не призводили до летального результату. Нетоксична доза (NOAEL) у щурів не була встановлена. У мавп, що отримували лікування протягом 20 місяців, таких пухлин не виявлено. Пухлини у гризунів обумовлені негенотоксичним специфічним ГПП-1-рецептор-опосередкованим механізмом, до якого частково чутливі гризуни. Значущість цього механізму у людей достатньо низька, але не може бути повністю виключена. Розвитку інших пухлин не було виявлено. У процесі досліджень на тваринах не було виявлено прямого шкідливого впливу на фертильність, проте при введенні найвищих доз відзначалося незначне підвищення ранньої ембріональної летальності. Введення ліраглутиду в період середини вагітності спричиняло зниження маси тіла самки, уповільнення росту плода з нез’ясованим впливом на розвиток ребер у щурів і скелета у кроликів. При введенні ліраглутиду відзначено уповільнення росту новонароджених щурів, що зберігається в період відлучення від годування молоком у групі прийому високої дози. Невідомо, чи уповільнення росту новонароджених щурів обумовлене зниженням споживання ними молока в результаті прямого впливу ГПП-1, чи зменшенням молока у матері, що обумовлено зниженням калорійності споживаної їжі.
У ювенільних щурів застосування ліраглутиду призводило до затримки статевого дозрівання як самців, так і самок за клінічно значимих концентрацій препарату в плазмі крові. Такі затримки не впливали на фертильність і репродуктивну здатність самок та самців чи на здатність самок виношувати вагітність.
Діти
Дослідження лікарської взаємодії проводились лише за участю дорослих пацієнтів.
Діти
У дітей ≥ 12 років, які отримували лікування ліраглутидом, повідомлялося про епізоди клінічно значущої гіпоглікемії. Пацієнтів слід проінформувати про характерні симптоми гіпоглікемії та відповідні заходи.
Гіперглікемія у пацієнтів з цукровим діабетом 2 типу, які отримують інсулін
У пацієнтів з цукровим діабетом 2 типу лікарський засіб Саксенда® не можна застосовувати як заміну інсуліну. Повідомлялося про розвиток діабетичного кетоацидозу у інсулінозалежних пацієнтів у разі швидкого припинення застосування або зменшення дози інсуліну (див. розділ «Спосіб застосування та дози»).
Допоміжні речовини
Саксенда® містить менше ніж 1 ммоль натрію (23 мг), тому лікарський засіб можна вважати таким, що не містить натрію.
Діти
Для дітей віком від 12 років корекція дози не потрібна. Безпеку та ефективність застосування лікарського засобу Саксенда® дітям віком до 12 років не встановлено (див. розділ «Фармакодинаміка»).
Діти
У ході клінічного дослідження за участю дітей віком від 12 років із ожирінням 125 пацієнтів приймали лікарський засіб Саксенда® впродовж 56 тижнів.
Загалом частота, тип і тяжкість небажаних реакцій у дітей ≥ 12 років з ожирінням були зіставними із такими у дорослих пацієнтів. Порівняно з дорослими пацієнтами у дітей від 12 років удвічі частіше спостерігалось блювання.
Відсоток пацієнтів, які повідомили принаймні про один епізод клінічно значущої гіпоглікемії, був вищим у групі застосування ліраглутиду (1,6 %), ніж у групі плацебо (0,8 %). Під час проведення дослідження не зареєстровано жодного епізоду тяжкої гіпоглікемії.
Повідомлення про небажані реакції та відсутність ефективності лікарського засобу
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням https://aisf.dec.gov.ua.
Показання
Лікарський засіб Саксенда® застосовують для зменшення маси тіла як доповнення до дієти зі зниженою калорійністю та збільшеною фізичною активністю у дорослих пацієнтів з початковим індексом маси тіла (ІМТ) більше 30 кг/м2 (ожиріння) або від 27 до 30 кг/м2 (надмірна маса тіла) за наявності хоча б одного супутнього захворювання, пов’язаного з масою тіла, такого як дисглікемія (переддіабет або цукровий діабет 2 типу), гіпертензія, дисліпідемія або обструктивне апное сну.
Якщо через 12 тижнів після прийому добової дози 3,0 мг пацієнт не втратив щонайменше 5 % від початкової маси тіла, застосування лікарського засобу Саксенда® слід припинити.
Діти ≥ 12 років
Лікарський засіб Саксенда® можна застосовувати як доповнення до здорового харчування та збільшеної фізичної активності для корекції маси тіла у пацієнтів дитячого віку від 12 років із:
ожирінням (ІМТ ≥ 30 кг/м2 для дорослих пацієнтів за міжнародними гранично допустимими значеннями)* та
масою тіла більш ніж 60 кг.
Лікування препаратом Саксенда® слід припинити і переглянути, якщо пацієнт не втратив щонайменше 4 % свого ІМТ або ІМТ за оцінкою Z-score через 12 тижнів застосування препарату в дозі 3,0 мг/добу чи в максимальній переносимій дозі.
* Гранично допустимі значення ІМТ, встановлені Міжнародною робочою групою з вивчення ожиріння, для пацієнтів віком 12–18 років із ожирінням у розбивці за статтю (див. табл. 7).
Таблиця 7
Гранично допустимі значення ІМТ, встановлені Міжнародною робочою групою з вивчення ожиріння, для пацієнтів із ожирінням у віці 12–18 років у розбивці за статтю
Вік
(років)
ІМТ, який відповідає 30 кг/м2 для дорослих пацієнтів за міжнародними гранично допустимими значеннями
Хлопці
Дівчата
12
26,02
26,67
12,5
26,43
27,24
13
26,84
27,76
13,5
27,25
28,20
14
27,63
28,57
14,5
27,98
28,87
15
28,30
29,11
15,5
28,60
29,29
16
28,88
29,43
16,5
29,14
29,56
17
29,41
29,69
17,5
29,70
29,84
18
30,00
30,00
Підвищена чутливість до діючої речовини або до інших компонентів лікарського засобу.
Взаємодія з іншими лікарськими засобами та інші види взаємодії
Іn vitro ліраглутид продемонстрував дуже низький потенціал впливу на фармакокінетику інших активних субстанцій, обмін яких пов’язаний із цитохромом Р450, а також зв’язування з білками плазми крові.
Ліраглутид спричинює незначну затримку випорожнення шлунка, що може вплинути на всмоктування пероральних препаратів, що застосовуються одночасно. Дослідження щодо взаємодії не показали будь-якого клінічно значущого уповільнення всмоктування, тому корекція дози не потрібна.
Дослідження взаємодії проводили при застосуванні ліраглутиду в дозі 1,8 мг. Вплив на швидкість випорожнення шлунка був еквівалентним до ліраглутиду в дозі 1,8 мг та 3,0 мг (парацетамол AUC0-300 хв). Зареєстрований щонайменше один епізод виникнення гострої діареї у деяких пацієнтів, які отримували лікарський засіб Саксенда®. Діарея може порушувати всмоктування пероральних лікарських засобів, що одночасно приймаються.
Варфарин та інші похідні кумарину
Досліджень лікарської взаємодії не проводили. Не можна виключити клінічно значущу взаємодію з активною субстанцією, що має низьку розчинність або вузький терапевтичний індекс, такою як варфарин. На початку лікування ліраглутидом у пацієнтів, які одержують варфарин або інші похідні кумарину, рекомендується частіше проводити контроль міжнародного нормалізованого співвідношення (МНС).
Парацетамол
Ліраглутид не змінював загальну експозицію парацетамолу після введення одноразової дози 1000 мг. Максимальна концентрація парацетамолу (Cmax) знижувалася на 31 %, а медіана часу досягнення максимальної концентрації (tmax) збільшувалася до 15 хвилин. При одночасному застосуванні парацетамолу корекція дози не потрібна.
Аторвастатин
Ліраглутид не змінював загальну експозицію аторвастатину до клінічно значущого рівня після одноразового його введення в дозі 40 мг. У зв’язку з цим при одночасному застосуванні з ліраглутидом корекція дози аторвастатину не потрібна. При одночасному введенні з ліраглутидом Cmax аторвастатину знижувалася на 38 %, а медіана tmax збільшувалася з 1 години до 3 годин.
Гризеофульвін
Ліраглутид не змінював загальної експозиції гризеофульвіну після одноразового його введення в дозі 500 мг. Cmax гризеофульвіну зростала на 37 %, тоді як медіана tmax не змінювалася. Коригування дози гризеофульвіну та інших низькорозчинних сполук з високою проникністю не потрібне.
Дигоксин|
Після одноразового введення 1 мг дигоксину у поєднанні з ліраглутидом відмічено зменшення значення площі під кривою «концентрація-час» (AUC) для дигоксину на 16 %; Cmax знижувалася на 31 %. Медіана tmax дигоксину збільшувалася з 1 години до 1,5 години. Виходячи з даних результатів, корекція дози дигоксину не потрібна.
Лізиноприл
Після одноразового застосування 20 мг лізиноприлу з ліраглутидом відмічено зменшення AUC для лізиноприлу на 15 %, Cmax знижувалася на 27 %. Медіана tmax лізиноприлу збільшувалася з 6 до 8 годин. Виходячи з даних результатів, корекція дози лізиноприлу не потрібна.
Пероральні контрацептиви
При одночасному застосуванні разової дози пероральних контрацептивів ліраглутид знижував Cmax етинілестрадіолу або левоноргестрелу на 12 % і 13 % відповідно, а tmax збільшувався на 1,5 години. Це не мало клінічно значущого впливу на загальну експозицію етинілестрадіолу або левоноргестрелу, що дає підставу вважати, що одночасний прийом їх з ліраглутидом не вплине на контрацептивний ефект етинілестрадіолу та левоноргестрелу.
Спостереження
З метою покращення спостереження за біологічними лікарськими засобами, назва та номер серії препарату, що вводиться, повинні бути чітко записані.
Аспірація в поєднанні із загальною анестезією або глибокою седацією
У пацієнтів, які отримували агоністи рецепторів ГПП-1, спостерігалися випадки легеневої аспірації під час їх перебування під загальною анестезією або у стані глибокої седації. Тому перед виконанням процедури із використанням загальної анестезії або глибокої седації слід враховувати підвищений ризик наявності залишкового вмісту шлунка внаслідок затримки випорожнення шлунка (див. розділ «Побічні реакції»).
Серцева недостатність
Немає клінічного досвіду лікування пацієнтів із застійною серцевою недостатністю IV класу за класифікацією Нью-Йоркської асоціації кардіологів (NYHA), тому ліраглутид не рекомендовано застосовувати цим пацієнтам.
Особливі групи пацієнтів
Безпека та ефективність застосування ліраглутиду для корекції маси тіла не встановлені у пацієнтів:
віком ≥ 75 років;
які застосовують інші лікарські засоби для корекції маси тіла;
із вторинним ожирінням, викликаним ендокринологічними розладами чи розладами, пов’язаними з харчуванням, або в результаті застосування лікарських засобів, що можуть спричинити збільшення маси тіла;
з тяжким порушенням функції нирок;
з тяжким порушенням функції печінки.
Не рекомендується застосовувати лікарський засіб Саксенда® даним групам пацієнтів (див. розділ «Дозування»).
Оскільки дослідження щодо застосування ліраглутиду для корекції маси тіла в пацієнтів з легкими або помірними порушеннями функції печінки відсутні, його слід з обережністю застосовувати цій групі пацієнтів (див. розділи «Фармакокінетика» та «Дозування»).
Досвід застосування ліраглутиду у пацієнтів із запальними захворюваннями кишечнику і діабетичним гастропарезом обмежений. Застосування ліраглутиду цим пацієнтам не рекомендовано, оскільки воно супроводжується тимчасовими побічними реакціями з боку шлунково-кишкового тракту, в т. ч. нудотою, блюванням і діареєю.
Панкреатит
Спостерігались випадки гострого панкреатиту при застосуванні аналогів рецептора ГПП-1.
Пацієнтів слід проінформувати про характерні симптоми гострого панкреатиту. При підозрі на панкреатит слід відмінити лікування ліраглутидом. Якщо підтверджується гострий панкреатит, повторне застосування ліраглутиду не рекомендоване.
Жовчнокам’яна хвороба та холецистит
У клінічних випробуваннях у пацієнтів, які застосовували ліраглутид для зменшення маси тіла, спостерігалася більша частота виникнення жовчнокам’яної хвороби та холециститу порівняно з пацієнтами, які отримували плацебо. Той факт, що швидка втрата маси тіла може збільшити ризик розвитку жовчнокам’яної хвороби і, отже, холециститу, лише частково пояснює більш високу частоту виникнення даних захворювань при застосуванні ліраглутиду. Жовчнокам’яна хвороба та холецистит можуть призвести до госпіталізації та холецистектомії. Пацієнтів слід поінформувати про характерні симптоми жовчнокам’яної хвороби та холециститу.
Захворювання щитоподібної залози
У процесі клінічних досліджень цукрового діабету 2 типу відмічені побічні реакції з боку щитоподібної залози, такі як зоб, особливо у пацієнтів з уже наявними захворюваннями щитоподібної залози. Тому ліраглутид слід з обережністю застосовувати цим пацієнтам.
Частота серцевих скорочень
Під час клінічних досліджень ліраглутиду спостерігалося збільшення частоти серцевих скорочень (див. розділ «Фармакодинаміка»). Частоту серцевих скорочень слід контролювати через рівні проміжки часу відповідно до звичайної клінічної практики. Пацієнтів слід проінформувати про симптоми збільшення частоти серцевих скорочень (підвищене серцебиття або відчуття підвищеного серцебиття в спокої). Пацієнтам, у яких спостерігається клінічно значуще стійке збільшення частоти серцевих скорочень у спокої, лікування ліраглутидом слід припинити.
Зневоднення
У пацієнтів, які застосовували агоністи рецепторів ГПП-1, спостерігалися симптоми зневоднення, в тому числі порушення функції нирок та гострої ниркової недостатності. Пацієнтів, яким призначено ліраглутид, необхідно проінформувати про можливість зневоднення організму внаслідок розладів травної системи та необхідність вживання запобіжних заходів щодо зневоднення.
Гіпоглікемія у пацієнтів з цукровим діабетом 2 типу
У пацієнтів із цукровим діабетом 2 типу, які отримують ліраглутид одночасно з інсуліном та/або сульфонілсечовиною, може бути підвищений ризик виникнення гіпоглікемії. Ризик виникнення гіпоглікемії може бути знижений за допомогою зменшення дози інсуліну та/або сульфонілсечовини.
Вагітність
Адекватні дані щодо застосування ліраглутиду вагітним жінкам відсутні. Дослідження на тваринах показали репродуктивну токсичність (див. розділ «Доклінічні дані з безпеки»). Потенційний ризик для людей невідомий.
Ліраглутид не слід застосовувати під час вагітності. Якщо пацієнтка хоче завагітніти або вагітна, то прийом ліраглутиду необхідно відмінити.
Період годування груддю
Невідомо, чи екскретується ліраглутид у грудне молоко людини. Дослідження на тваринах показали, що в молоко потрапляє незначна кількість ліраглутиду і його близькоспоріднених структурних метаболітів. Доклінічні дослідження виявили пов’язане із застосуванням препарату зменшення темпів зростання новонароджених щуренят (див. розділ «Доклінічні дані про безпеку застосування»). У зв’язку з недостатнім досвідом застосування препарату у період годування груддю не слід застосовувати його в цей період.
Фертильність
Окрім незначного зменшення кількості живих імплантованих ембріонів, дослідження на тваринах не виявили шкідливого впливу препарату на репродуктивну здатність (див. розділ «Доклінічні дані про безпеку застосування»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Лікарський засіб Саксенда® не впливає або має незначний вплив на здатність керувати транспортними засобами й іншими механізмами. Однак може виникати запаморочення здебільшого протягом перших 3 місяців лікування лікарським засобом Саксенда®. Слід з обережністю керувати автотранспортом або іншими механізмами при виникненні запаморочення.
Дорослі
Початкова доза становить 0,6 мг на добу. Для поліпшення переносимості з боку шлунково-кишкового тракту дозу слід підвищувати щотижня на 0,6 мг до досягнення добової дози 3,0 мг (див. таблицю 8).
У разі поганої переносимості наступної підвищеної дози протягом двох послідовних тижнів слід розглянути питання про припинення лікування. Добова доза вище 3,0 мг не рекомендується.
Таблиця 8
Графік підвищення дози
Доза, мг
Тижні
Збільшення дози протягом
4 тижнів
0,6
1
1,2
1
1,8
1
2,4
1
Підтримуюча доза
3,0 мг
Діти ≥ 12 років
Для дітей віком від 12 років слід застосовувати таку ж схему підвищення дози, як і для дорослих (див. таблицю 8). Дозу слід збільшувати до досягнення 3,0 мг (підтримуюча доза) або максимальної переносимої дози. Добові дози вище 3,0 мг не рекомендуються.
Пропущена доза
Якщо ін’єкція пропущена протягом 12 годин з моменту її звичайного введення, пацієнт повинен прийняти дозу якнайшвидше. Якщо до наступного введення залишається менше 12 годин, пацієнт не повинен приймати пропущену дозу, а продовжувати режим прийому 1 раз на добу – прийняти наступну заплановану дозу препарату. Не слід приймати додаткову дозу чи збільшувати дозу для компенсації пропущеної ін’єкції.
Пацієнти з цукровим діабетом 2 типу
Лікарський засіб Саксенда® не слід застосовувати в комбінації з іншими агоністами рецепторів ГПП-1. Для зниження ризику розвитку гіпоглікемії на початку застосування лікарського засобу Саксенда® слід розглянути можливість зменшення дози одночасно застосовуваних інсуліну або стимуляторів секреції інсуліну (наприклад, сульфонілсечовини). Необхідний самоконтроль рівня глюкози в крові для коригування дози інсуліну чи стимуляторів секреції інсуліну (див. розділ «Особливості застосування»).
Особливі групи пацієнтів
Пацієнти літнього віку (≥65 років)
Корекція дози у зв’язку з віком не потрібна. Досвід застосування препарату пацієнтам ≥75 років обмежений, тому не рекомендовано застосовувати його даній категорії пацієнтів (див. розділи «Фармакокінетика» та «Особливості застосування»).
Пацієнти з порушеннями функції нирок
Корекція дози не потрібна у пацієнтів з легким або середнім ступенем порушення функції нирок (кліренс креатиніну ≥30 мл/хв). Не рекомендується застосовувати лікарський засіб Саксенда® пацієнтам з тяжким порушенням функції нирок (кліренс креатиніну <30 мл/хв), включаючи пацієнтів із термінальною стадією порушення функції нирок (див. розділи «Фармакокінетика», «Особливості застосування» та «Побічні реакції»).
Пацієнти з порушеннями функції печінки
Не рекомендується коригування дози пацієнтам з легким або середнім ступенем порушення функції печінки. Застосування лікарського засобу Саксенда® не рекомендується пацієнтам з тяжким порушенням функції печінки, а пацієнтам із легким або помірним порушенням функції печінки препарат слід застосовувати з обережністю (див. розділи «Фармакокінетика» та «Особливості застосування»).
Спосіб введення
Лікарський засіб Саксенда® призначений тільки для підшкірного введення. Його не можна вводити внутрішньовенно або внутрішньом’язово.
Препарат вводять підшкірно 1 раз на добу у будь-який час незалежно від вживання їжі. Його можна вводити підшкірно в ділянку передньої черевної стінки, стегна або плеча. Місце і час введення можна змінювати без корекції дози, проте бажано вводити приблизно в один і той же найбільш зручний час.
Нижче наводиться інструкція з використання шприц-ручки для введення лікарського засобу.
З метою зменшення ризику утворення відкладень амілоїдози при ін’єкції, необхідно завжди змінювати місце ін’єкції (див. розділ «Побічні рекації»).
Інструкція з використання шприц-ручки Саксенда®
Перед використанням шприц-ручки Саксенда® необхідно уважно причитати цю інструкцію.
Не користуватися шприц-ручкою без отримання належної інформації щодо її використання від лікаря чи медсестри.
препарату необхідно почати з перевірки шприц-ручки, щоб бути впевненим, що вона містить саме лікарський засіб Саксенда®, 6 мг/мл. Потім потрібно подивитися рисунки нижче, щоб дізнатися про різні частини шприц-ручки та голки.
Незрячим пацієнтам та пацієнтам з поганим зором не можна користуватися шприц-ручкою без сторонньої допомоги. Допомагати має людина з хорошим зором, яка може побачити лічильник дози на шприц-ручці Саксенда® та яка вміє користуватися нею.
Шприц-ручка Саксенда® є попередньо заповненою. Вона містить 18 мг ліраглутиду, що дає змогу ввести дози 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг та 3,0 мг. Шприц-ручка Саксенда® призначена для використання з одноразовими голками НовоФайн® або НовоТвіст® довжиною до 8 мм і товщиною 32G. Голки не входять у комплект.
Важлива інформація
Необхідно звернути особливу увагу на цю позначку, оскільки вона є важливою для безпечного користування шприц-ручкою.
Шприц-ручка Саксенда® та голка (приклад)
1. Підготовка шприц-ручки з новою голкою для використання
;Перевірте назву та кольорову етикетку Вашої шприц-ручки, щоб бути впевненим, що вона містить лікарський засіб Саксенда®. Це особливо важливо в тому випадку, якщо Ви застосовуєте різні ін’єкційні лікарські засоби. Застосування неправильного лікарського засобу може бути шкідливим для Вашого здоров’я.
;Зніміть ковпачок шприц-ручки.
;Переконайтеся, що розчин у шприц-ручці прозорий та безбарвний. Подивіться у вікно шкали картриджа. Якщо препарат мутний, шприц-ручку використовувати заборонено.
;Візьміть нову одноразову голку та видаліть з неї захисну мембрану.
;Переконайтеся, що голка прикріплена правильно.
;Нагвинтіть голку на шприц-ручку та поверніть її, щоб голка щільно трималась на шприц-ручці.
;Голка закрита двома ковпачками. Ви повинні зняти обидва ковпачки. Якщо ви забудете зняти обидва ковпачки, ви не зробите ін’єкцію розчину.
;Зніміть зовнішній ковпачок голки та збережіть його. Він знадобиться після завершення ін’єкції для безпечного зняття голки.
;Зніміть внутрішній ковпачок голки та викиньте його. Якщо Ви спробуєте надіти внутрішній ковпачок знову на голку, то можете поранитись. На кінці голки може з’явитися крапля розчину. Це нормальне явище, проте необхідно перевірити надходження препарату при використанні нової шприц-ручки вперше.
Не приєднуйте нову голку до тих пір, поки не будете готові зробити ін’єкцію.
![]() Для кожної ін’єкції завжди використовуйте нову
голку. Це зменшить ризик закупорки голки, зараження, потрапляння інфекції та введення неправильної дози препарату.
Для кожної ін’єкції завжди використовуйте нову
голку. Це зменшить ризик закупорки голки, зараження, потрапляння інфекції та введення неправильної дози препарату.
![]() Ніколи не використовуйте голку, якщо вона погнута чи
пошкоджена.
Ніколи не використовуйте голку, якщо вона погнута чи
пошкоджена.
2. Перевірка потоку розчину з кожної нової шприц-ручки
Якщо Ви вже використовували цю шприц-ручку, переходьте до пункту 3 «Виставлення дози». Перевіряйте потік розчину лише перед першим застосуванням нової шприц-ручки.
Повертайте селектор дози до символу перевірки потоку
( ![]() ) прямо після «0». Переконайтеся, що символ перевірки
потоку збігається з покажчиком дози.
) прямо після «0». Переконайтеся, що символ перевірки
потоку збігається з покажчиком дози.
Тримайте шприц-ручку голкою вгору.
Натисніть і потримайте кнопку дози, поки лічильник дози не повернеться до «0». Значення «0» повинно відповідати покажчику дози. На кінчику голки повинна з’явитися крапля розчину.
На кінчику голки може залишитися невелика крапля, але вона не буде вводитися.
Якщо жодна крапля не з’явилася, поверніться до пункту 2 «Перевірка потоку розчину з нової шприц-ручки» до 6 разів. Якщо краплі все ще немає, змініть голку і повторіть дії, описані у пункті 2 «Перевірка потоку розчину з нової шприц-ручки» ще раз.
Якщо крапля все-таки не з’явилася, утилізуйте ручку і використовуйте нову.
![]() Потрібно завжди переконуватись, що крапля
з’являється на кінчику голки, перш ніж вперше використовувати нову ручку. Це гарантує, що розчин буде введений.
Потрібно завжди переконуватись, що крапля
з’являється на кінчику голки, перш ніж вперше використовувати нову ручку. Це гарантує, що розчин буде введений.
Якщо крапля не з’явиться, не використовуйте шприц-ручку, навіть якщо лічильник дози змінює значення. Це може вказувати на заблоковану або пошкоджену голку.
Якщо Ви не перевірите потік перед першою ін’єкцією нової ручки, то можете не отримати необхідну дозу розчину для забезпечення бажаної дії лікарського засобу Саксенда®.
3. Виставлення дози
;Повертайте селектор дози, поки лічильник дози не покаже необхідну дозу (0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг або 3,0 мг).
Якщо Ви вибрали неправильну дозу, можна повернути селектор дози вперед або назад до правильної дози.
Шприц-ручка вміщує максимум 3,0 мг препарату.
За допомогою селектора можна змінити дозу. Тільки лічильник дози та показник дози покажуть, яку кількість міліграмів Ви вибираєте для ін’єкції.
Ви можете вибрати до 3,0 мг лікарського засобу на дозу. Якщо шприц-ручка містить менше 3,0 мг, лічильник дози зупиняється до значення 3,0 мг.
Чути різне клацання селектора дози при обертанні вперед, назад або при виставленні залишкової кількості розчину. Не рахуйте клацання.
![]() Завжди використовуйте лічильник дози та покажчик дози,
щоб побачити, скільки міліграмів Ви вибрали перед введенням цього препарату.
Завжди використовуйте лічильник дози та покажчик дози,
щоб побачити, скільки міліграмів Ви вибрали перед введенням цього препарату.
Не рахуйте кількість клацань шприц-ручки.
Не використовуйте шкалу картриджа. Вона показує приблизну кількість розчину, яка залишилась у шприц-ручці.
За допомогою селектора дози повинні бути виставлені лише дози 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг або 3,0 мг. Цифри на дисплеї повинні точно збігатися з покажчиком дози, щоб забезпечити правильну дозу для введення.
Залишок розчину в шприц-ручці
;Шкала шприц-ручки показує приблизно, скільки розчину залишилось у шприц-ручці.
;Щоб точно побачити, скільки розчину залишилось, скористайтеся лічильником дози:
Повертайте селектор дози вліво, поки лічильник дози не зупиниться.
Якщо він показує 3,0, у шприц-ручці залишилося щонайменше 3,0 мг. Якщо лічильник дози зупиняється до 3,0 мг, значить у шприц-ручці не вистачає розчину для повної дози 3,0 мг.
Якщо Вам потрібна вища доза, ніж та, що залишилася у Вашій шприц-ручці.
Ви можете розділити свою дозу між Вашою поточною шприц-ручкою та новою шприц-ручкою тільки за умови, що Вас проінструктував лікар або медсестра. Використовуйте калькулятор, щоб спланувати дози згідно з інструкціями лікаря або медсестри. Будьте дуже обережні, щоб правильно розрахувати дозу.
Будьте дуже уважні, розраховуючи дозу.
Якщо Ви не впевнені, як розділити дозу за допомогою двох шприц-ручок, виберіть і введіть необхідну дозу новою шприц-ручкою.
4. Введення дози
;Введіть голку під шкіру так, як показав Вам лікар чи медсестра.
;Переконайтеся, що Ви бачите лічильник дози. Не закривайте лічильник пальцями. Це може перервати ін’єкцію.
Натисніть і утримуйте пускову кнопку. Спостерігайте, поки лічильник дози не повернеться до «0».
«0» повинен збігатися з покажчиком дози. Потім Ви можете почути або відчути клацання.
;Продовжуйте натискати пускову кнопку, утримуючи голку під шкірою.
Рахуйте повільно до 6, утримуючи натиснутою пускову кнопку.
Якщо голку витягти раніше, Ви можете побачити потік розчину з кінчика голки. В такому випадку правильна доза не буде введена.
Витягніть голку з-під шкіри. Після цього можна відпустити пускову кнопку.
Якщо крапля крові з’явилась у місці ін’єкції, легенько притисніть це місце.
Ви можете побачити краплю розчину на кінчику голки після введення. Це нормально і не впливає на об’єм введеної дози.
Завжди дивіться на покажчик дози, щоб бачити скільки міліграмів розчину Ви ввели.
Тримайте натиснутою пускову кнопку, поки покажчик дози не покаже знову «0».
Як виявити заблоковану чи пошкоджену голку?
Якщо «0» не відображається на лічильнику дози після постійного натискання пускової кнопки, можливо, Ви використали заблоковану або пошкоджену голку.
У цьому випадку Ви не ввели потрібну кількість лікарського засобу, навіть незважаючи на те, що лічильник дози перемістився від раніше встановленої дози.
Як поводитися із заблокованою голкою?
Зніміть голку, як описано в пункті 5 «Після ін’єкції» і повторіть дії, описані в усіх пунктах, починаючи з пункту 1 «Підготовка шприц-ручки з новою голкою для використання»
Ніколи не торкайтеся лічильника під час введення лікарського засобу. Це може перервати ін’єкцію.
5. Після ін’єкції
;Завжди утилізуйте голку після кожної ін’єкції, щоб забезпечити зручність ін’єкції та запобігти використанню заблокованої голки. Якщо голка заблокована, Ви не зможете ввести лікарський засіб.
Покладіть зовнішній ковпачок голки на пласку поверхню і надіньте зовнішній ковпачок на голку, не торкаючись голки та зовнішнього ковпачка голки
Як тільки голка накривається, обережно повністю натисніть на зовнішній ковпачок голки.
Обережно викрутіть голку та утилізуйте за інструкціями, отриманими від лікаря, медсестри, фармацевта, або відповідно до місцевих правил.
Закривайте кришкою шприц-ручку після кожного використання, щоб захистити розчин від світла.
Коли ручка порожня, викиньте її без голки за інструкціями, отриманими від лікаря, медсестри, фармацевта, або відповідно до місцевих правил.
Ніколи не намагайтеся надіти внутрішній ковпачок голки назад на голку. Ви можете поранитися голкою.
Завжди виймайте голку з ручки після кожної ін’єкції. Це може запобігти заблокуванню голки, забрудненню, зараженню, протіканню розчину та неточному дозуванню.
Важлива інформація
Завжди тримайте шприц-ручку та голки в недоступному місці для інших людей, особливо дітей.
Ніколи не передавайте Вашу особисту шприц-ручку чи голки іншим людьми.
Люди, що доглядають, мають бути дуже обережними при роботі з використаними голками, щоб запобігти травмуванню голкою та перехресному зараженню.
Догляд за Вашою шприц-ручкою
Не залишайте Вашу шприц-ручку в машині чи іншому місці, де може бути дуже жарко або занадто холодно.
Не вводити лікарський засіб Саксенда®, який був заморожений. У такому разі ви можете не отримати очікуваного лікувального ефекту від цього препарату.
Зберігайте шприц-ручку від пилу, бруду та рідин.
Не мийте, не замочуйте та не змащуйте шприц-ручку. Її можна очистити за допомогою тканини, змоченої м’яким миючим засобом.
Запобігайте падінню та ударам шприц-ручки об тверді поверхні. В разі падіння чи удару приєднайте нову голку і перевірте подачу розчину перед введенням.
Не намагайтеся повторно наповнити шприц-ручку. Утилізуйте шприц-ручку після закінчення в ній розчину.
Не намагайтеся самостійно полагодити шприц-ручку або розібрати її на частини.
У клінічних дослідженнях та протягом постмаркетингового застосування лікарського засобу Саксенда® повідомлялося про випадки передозування до 72 мг (у 24 рази більше рекомендованої підтримуючої дози). Події, про які повідомлялося, включали сильну нудоту, сильне блювання та тяжку гіпоглікемію.
У разі передозування слід розпочати підтримуюче лікування відповідно до наявних у пацієнта клінічних ознак і симптомів. Необхідно спостерігати за станом пацієнта щодо клінічних ознак зневоднення та контролювати рівень глюкози в крові.
Резюме профілю безпеки
Безпека застосування лікарського засобу Саксенда® була оцінена у 5 подвійно сліпих рандомізованих плацебо-контрольованих клінічних дослідженнях за участю 5813 дорослих пацієнтів з ожирінням або надмірною масою тіла із хоча б одним супутнім захворюванням, пов’язаним з надмірною масою тіла. Загалом найбільш частими побічними реакціями були розлади травної системи (67,9 %) (див. розділ «Опис окремих побічних реакцій»).
Список побічних реакцій
Нижче зазначені побічні реакції, про які повідомлялося у дорослих. Побічні реакції класифіковані за системами органів та частотою виникнення. Оцінку частоти виникнення побічних реакцій проводили за такою шкалою: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1000 до < 1/100), рідко (від ≥ 1/10000 до < 1/1000), дуже рідко (< 1/10000) та частота невідома (не можна визначити на основі наявних даних). У кожній групі побічні реакції наведені в порядку зниження їх серйозності.
З боку імунної системи: рідко – анафілактичні реакції.
Порушення метаболізму і харчування: часто – гіпоглікемія*; нечасто – зневоднення.
Психічні розлади: часто – безсоння**.
З боку нервової системи: дуже часто – головний біль; часто – запаморочення, дисгевзія.
З боку серцево-судинної системи: нечасто – тахікардія.
З боку травної системи: дуже часто – нудота, блювання, діарея, запор; часто - сухість у роті, диспепсія, гастрит, гастроезофагеальна рефлюксна хвороба, біль у верхньому відділі черевної порожнини, метеоризм, еруктація, здуття живота; нечасто – панкреатит***, затримка випорожнення шлунка****; частота невідома – кишкова непрохідність†.
З боку печінки та жовчних шляхів: часто – жовчнокам’яна хвороба***; нечасто – холецистит***.
З боку шкіри та підшкірних тканин: часто – висип, нечасто – кропив’янка, невідомо – амілоїдоз шкіри.
З боку нирок та сечовивідних шляхів: рідко – гостра ниркова недостатність, порушення функції нирок.
Загальні розлади та реакції в місці ін’єкції: часто – реакції в місцях ін’єкцій, астенія, втома; нечасто – нездужання.
Лабораторні дослідження: часто – підвищений рівень ліпази, підвищений рівень амілази.
* Гіпоглікемія (базується на симптомах, про які повідомляли самі пацієнти і які не підтверджені вимірюваннями рівня глюкози в крові) виникала у пацієнтів, які не страждають на цукровий діабет 2 типу та які застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю. Для отримання додаткової інформації див. розділ «Опис окремих побічних реакцій».
** Безсоння, в основному спостерігалося протягом перших 3 місяців лікування.
*** Див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій».
**** З контрольованої фази 2, За та Зб клінічних досліджень.
† Побічні реакції, відомі з постмаркетингового досвіду.
окремих побічних реакцій
Гіпоглікемія в пацієнтів, які не страждають на цукровий діабет 2 типу
У процесі клінічних випробувань не було зафіксованого жодного тяжкого випадку виникнення гіпоглікемії (що потребує сторонньої допомоги) у пацієнтів з надмірною масою тіла чи ожирінням, які не страждали на цукровий діабет 2 типу та застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю. Про виникнення симптомів гіпоглікемії повідомили 1,6 % пацієнтів, які отримували лікарський засіб Саксенда®, та 1,1 % пацієнтів, які отримували плацебо. Однак ці випадки не були підтверджені вимірюванням рівня глюкози в крові. Більшість випадків легко переносились.
Гіпоглікемія у хворих на цукровий діабет 2 типу
У клінічному досліджені були повідомлення про випадки тяжкої гіпоглікемії у 0,7 % пацієнтів з надмірною масою тіла чи ожирінням, які страждали на цукровий діабет 2 типу й застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю та які застосовували сульфонілсечовину. Також зафіксовано виникнення симптомів гіпоглікемії у 43,6 % пацієнтів, які застосовували лікарський засіб Саксенда®, та у 27,3 % пацієнтів, які отримували плацебо. Серед пацієнтів, які не застосовували сульфонілсечовину, було зафіксовано виникнення симптомів гіпоглікемії (визначаються концентрацією глюкози у плазмі крові ≤ 3,9 ммоль/л) у 15,7 % пацієнтів, які отримували лікарський засіб Саксенда®, та у 7,6 % пацієнтів, які отримували плацебо.
Гіпоглікемія у хворих на цукровий діабет 2 типу, які отримують інсулін
У процесі клінічного дослідження були повідомлення про випадки тяжкої гіпоглікемії (що потребує сторонньої допомоги) у 1,5 % пацієнтів з надмірною масою тіла чи ожирінням, які страждали на цукровий діабет 2 типу та застосовували інсулін та ліраглутид в дозі 3,0 мг/добу у поєднанні з дієтою та фізичною активністю і застосуванням до 2 пероральних протидіабетичних препаратів. В цьому дослідженні було зафіксовано виникнення симптоматичної гіпоглікемії (визначена як рівень глюкози в плазмі крові ≤ 3,9 ммоль/л, що супроводжується симптомами) у 47,2 % пацієнтів, які отримували ліраглутид у дозі 3,0 мг/добу, та у 51,8 % пацієнтів, які отримували плацебо. Серед пацієнтів, які застосовували сульфонілсечовину, були зафіксовані повідомлення про виникнення симптомів гіпоглікемії у 60,9 % пацієнтів, які отримували ліраглутид 3,0 мг/добу, та у 60,0 % пацієнтів, які отримували плацебо.
Розлади травної системи
Більшість випадків виникнення розладів травної системи були легкого або помірного ступеня тяжкості та не призводили до припинення терапії. Зазвичай реакції виникали протягом перших тижнів лікування і зменшувались протягом декількох днів або тижнів при продовженні лікування.
У пацієнтів віком від 65 років при застосуванні лікарського засобу Саксенда® частіше спостерігатися порушення з боку травної системи.
У пацієнтів з порушеннями функції нирок легкої або середньої тяжкості (кліренс креатиніну ≥ 30 мл/хв) при застосуванні лікарського засобу Саксенда® можуть частіше виникати порушення з боку травної системи.
Гостра ниркова недостатність
Зафіксовано випадки виникнення гострої ниркової недостатності у пацієнтів, які застосовували агоністи рецепторів ГПП-1. Більшість зареєстрованих випадків спостерігали у пацієнтів, які страждали на нудоту, блювання та діарею, що і призводило до втрати рідини (див. розділ «Особливості застосування»).
Алергічні реакції
Були повідомлення про кілька випадків виникнення анафілактичних реакцій, що супроводжувались такими симптомами як гіпотензія, підвищене серцебиття, напади задухи та набряки після застосування ліраглутиду. Анафілактичні реакції можуть бути небезпечними для життя. Тому якщо є підозра на виникнення анафілактичної реакції, слід припинити застосування ліраглутиду (див. розділ «Протипоказання»).
Реакції в місці ін’єкції
Повідомлялось про реакції в місці введення лікарського засобу Саксенда®. Ці реакції зазвичай були легкими, більшість із них зникали в процесі подальшого лікування.
Тахікардія
У процесі клінічних досліджень були повідомлення про випадки тахікардії у 0,6 % пацієнтів, які отримували лікарський засіб Саксенда®, та у 0,1 % пацієнтів, які отримували плацебо. Більшість випадків були легкого або помірного ступеня тяжкості. Випадки були поодинокими, більшість із них зникали в процесі подальшого лікування.
Амілоїдоз шкіри
Амілоїдоз шкіри може виникнути в місці ін'єкції (див. розділ «Спосіб застосування та дози»).
30 місяців.
Дату завершення терміну придатності зазначено на маркуванні шприц-ручки та картонній упаковці після слів «Придатн. до».
Після першого застосування – 1 місяць.
Зберігати в недоступному для дітей місці.
Зберігати в холодильнику (2–8 °С) подалі від морозильної камери.
Після першого застосування зберігати при температурі нижче 30 °С або в холодильнику
(2–8 °С). Не заморожувати.
Для запобігання дії світла зберігати шприц-ручку із закритим ковпачком.
Несумісність
Додавання до лікарського засобу Саксенда® будь-якої субстанції може призвести до деградації ліраглутиду. Оскільки дослідження сумісності не проводилися, цей лікарський засіб не можна застосовувати з іншими лікарськими засобами.
Попередньо заповнена багатодозова одноразова шприц-ручка, виготовлена з поліпропілену, поліацеталу, полікарбонату та акрилонітрилу бутадієну стиролу, містить картридж (скло типу I) разом із поршнем (бромбутил) та ламіновану гумову прокладку (бромбулит/поліізопрен).
Кожна шприц-ручка містить 3 мл розчину, що дає можливість ввести дози по 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг та 3,0 мг.
Упаковка містить 1, 3 або 5 попередньо заповнених шприц-ручок.
За рецептом.
А/Т Ново Нордіск.
Місцезнаходження заявника/виробника та адреса місця провадження його діяльності.
Ново Аллє
2880, Багсваерд
Данія.
Саксенда розчин д/ін. 6 мг/мл по 3 мл №3 у картр., вклад. у багатодоз. однораз. шпр.-руч.
Складдіюча речовина: ліраглутид;
1 мл розчину містить 6 мг ліраглутиду – аналога людського глюкагоноподібного пептиду-1 (ГПП-1), виготовленого за технологією рекомбінантної ДНК в Saccharomyces cerevisiae;
одна попередньо заповнена шприц-ручка містить 18 мг ліраглутиду в 3 мл;
допоміжні речовини: натрію гідрофосфат, дигідрат; пропіленгліколь; фенол; кислота хлористоводнева (для корекції рН); натрію гідроксид (для корекції рН); вода для ін’єкцій.
Лікарська формаРозчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий та безбарвний або майже безбарвний ізотонічний розчин; рН=8,15.
Фармакотерапевтична групаПрепарати, що застосовуються при цукровому діабеті, аналоги глюкагоноподібного пептиду-1 (ГПП-1). Код ATХ A10B J02.
Фармакологічні властивостіФармакодинаміка.
Механізм діїЛіраглутид є ацильованим аналогом ГПП-1 з послідовністю амінокислот на 97 % гомологічною ендогенному людському ГПП-1. Ліраглутид зв’язується з ГПП-1-рецепторами та активує їх.
ГПП-1 є фізіологічним регулятором апетиту та споживання їжі, але точний механізм його дії повністю не встановлений. У дослідженнях на тваринах периферійне введення ліраглутиду призвело до його накопичення в специфічних ділянках мозку, що відповідають за регуляцію апетиту, де ліраглутид завдяки специфічній активації рецепторів ГПП-1 підвищував відчуття насичення і знижував сигнали голоду, що сприяло зниженню маси тіла.
Рецептори ГПП-1 також експресуються у певних ділянках серця, судин, імунній системі та нирках. При моделюванні атеросклерозу у мишей ліраглутид запобігав прогресуванню аортальної атеросклеротичної бляшки та знижував запалення в бляшці. Крім того, ліраглутид позитивно впливав на ліпіди плазми. Ліраглутид не зменшував розмір вже наявних атеросклеротичних бляшок.
Фармакодинамічні ефекти
Ліраглутид знижує масу тіла у людей головним чином за рахунок втрати жирової маси, при цьому завдяки зменшенню переважно вісцерального жиру порівняно з підшкірним. Ліраглутид регулює апетит, підсилюючи відчуття ситості та наповненості шлунка, знижуючи при цьому відчуття голоду, та призводить до зниження споживання їжі. Ліраглутид не збільшує енерговитрати порівняно з плацебо.
Ліраглутид стимулює секрецію інсуліну та зменшує надмірно високу секрецію глюкагону залежно від рівня глюкози, що призводить до зниження глюкози натще та після вживання їжі.
У пацієнтів з переддіабетом та цукровим діабетом ефект зниження рівня глюкози більш виражений, порівняно з пацієнтами з нормоглікемією. Клінічні випробування свідчать, що ліраглутид покращує та підтримує функцію бета-клітин відповідно до НОМА-В та співвідношення проінсулін/інсулін.
Клінічна ефективність та безпека
Клінічна ефективність та безпека ліраглутиду при застосуванні для зниження маси тіла як доповнення до дієти зі зниженою калорійністю та збільшеною фізичною активністю були вивчені у чотирьох рандомізованих подвійних сліпих плацебо-контрольованих дослідженнях фази 3 за участі 5358 пацієнтів.
Дослідження 1 (SCALE Ожиріння та переддіабет – 1839):
Всього 3731 пацієнт із ожирінням (індекс маси тіла (ІМТ) ≥30 кг/м2) або з надмірною масою тіла (ІМТ ≥27 кг/м2) і дисліпідемією та/або артеріальною гіпертензією були стратифіковані за допомогою скринінгу відповідно до статусу переддіабету та початкового рівня ІМТ (≥ 30 кг/м2 або <30 кг/м2). Всі пацієнти (3731) були рандомізовані на лікування протягом 56 тижнів, а 2254 пацієнти, які мали переддіабет на момент скринінгу, були рандомізовані на лікування протягом 160 тижнів. Обидва періоди лікування супроводжувались 12-тижневим періодом спостереження за групами препарат/плацебо. Корекція способу життя у вигляді дієти зі зниженою калорійністю та збільшеною фізичною активністю була базовою терапією для всіх пацієнтів.
У 56-тижневому дослідженні 1 оцінювали зниження маси тіла у всіх (3731) рандомізованих пацієнтів (2590 пацієнтів завершили курс лікування).
У 160-тижневому дослідженні 1 оцінювали час до розвитку цукрового діабету 2 типу у 2254 рандомізованих пацієнтів з переддіабетом (1128 пацієнтів завершили курс лікування).
Дослідження 2 (SCALE Діабет – 1922):
Дослідження тривалістю 56 тижнів, у якому оцінювали зниження маси тіла у 846 рандомізованих пацієнтів із ожирінням та надмірною масою тіла (628 пацієнтів завершили курс лікування), які мали недостатньо контрольований цукровий діабет 2 типу (HbA1c в діапазоні 7–10 %). Основним методом лікування на початку дослідження була або дієта, або збільшена фізична активність, або застосування окремих лікарських засобів, таких як метформін, сульфонілсечовина та глітазон, або їх комбінацій.
Дослідження 3 (SCALE Апное під час сну – 3970):
Дослідження тривалістю 32 тижні, в якому оцінювали ступінь тяжкості апное під час сну та зниження маси тіла у 359 рандомізованих пацієнтів (276 пацієнтів завершили курс лікування) з ожирінням та обструктивним апное під час сну середнього або тяжкого ступеня.
Дослідження 4 (SCALE Підтримуюче лікування - 1923):
У дослідженні тривалістю 56 тижнів оцінювали підтримуюче лікування після зменшення маси тіла ≥5 %, спричиненого дієтою зі зниженою калорійністю, у 422 рандомізованих пацієнтів із ожирінням та надмірною масою тіла (305 пацієнтів завершили курс лікування) і артеріальною гіпертензією чи дисліпідемією.
Маса тіла
При застосуванні ліраглутиду було досягнуто кращого зниження маси тіла порівняно з плацебо у пацієнтів із ожирінням та надмірною масою тіла у всіх досліджуваних групах. У всіх популяціях дослідження більша частина пацієнтів досягала зниження маси тіла на ≥5 % та >10 % при застосуванні ліраглутиду порівняно з плацебо (таблиці 1–3). У 160-тижневій частині дослідження 1 зниження маси тіла відбувалося переважно в перший рік терапії і підтримувалося протягом всіх 160 тижнів.
У дослідженні 4 при застосуванні ліраглутиду більше пацієнтів утримували результат зниження маси тіла, досягнутий до початку лікування, порівняно з плацебо (81,4 % та 48,9 % відповідно). Конкретні дані досліджень 1–4 щодо зниження маси тіла, терміну лікування та кумулятивного розподілу зміни маси тіла (%) представлені в таблицях 1–5 і на рисунках 1, 2 і 3.
Зниження маси тіла через 12 тижнів при лікуванні ліраглутидом (3,0 мг)
Особами, які мали ранню відповідь на лікування, були пацієнти, які досягли ≥ 5 % зниження маси тіла після 12 тижнів застосування терапевтичної дози ліраглутиду (4 тижні ескалації дози та 12 тижнів прийому лікувальної дози). У дослідженні 1 тривалістю 56 тижнів 67,5 % пацієнтів досягли ≥ 5 % зниження маси тіла після 12 тижнів. У дослідженні 2 50,4 % пацієнтів досягли зниження маси тіла ≥ 5 % через 12 тижнів. При продовженні лікування прогнозується, що 86,2 % пацієнтів досягнуть зниження маси тіла ≥ 5 %, а 51 % пацієнтів – ≥ 10 % після застосування ліраглутиду протягом року. Середнє зниження маси тіла у пацієнтів, які застосовували ліраглутид протягом року, становила 11,2 % від їх початкової маси тіла (9,7 % для чоловіків і 11,6 % для жінок). Серед пацієнтів, які досягли < 5 % зниження маси тіла після 12 тижнів терапії, частка пацієнтів, які після року застосування ліраглутиду не досягли зменшення маси тіла ≥ 10 %, становила 93,4 %.
Контроль глікемії
Лікування ліраглутидом значно покращило показники глікемії у пацієнтів з нормоглікемією, переддіабетом та цукровим діабетом 2 типу. У 56-тижневій частині дослідження 1 цукровий діабет 2 типу розвинувся у меншої кількості пацієнтів, які отримували ліраглутид, порівняно з пацієнтами, які отримували плацебо (0,2 % проти 1,1 % відповідно). У більшості пацієнтів з переддіабетом на початку лікування спостерігався зворотний розвиток даного захворювання після застосування ліраглутиду порівняно з плацебо (69,2 % проти 32,7 % відповідно). Первинною кінцевою точкою ефективності у 160-тижневій частині дослідження 1 була частка пацієнтів, у яких виник цукровий діабет 2 типу, оцінена як час до розвитку цукрового діабету. На 160-му тижні дослідження у 3 % пацієнтів, які отримували лікарський засіб Саксенда®, і в 11 % пацієнтів, які отримували плацебо, діагностували цукровий діабет 2 типу. Розрахунковий час розвитку цукрового діабету 2 типу у пацієнтів, які отримували ліраглутид 3 мг, був у 2,7 раза довший (95 % ДІ [1,9; 3,9]), а коефіцієнт ризику розвитку цукрового діабету 2 типу становив 0,2 для ліраглутиду порівняно з плацебо.
Кардіометаболічні фактори ризику
Лікування ліраглутидом значно покращило показники систолічного артеріального тиску та окружності талії порівняно з плацебо (таблиці 1, 2 та 3).
Індекс апное-гіпное (ІАГ)
При застосуванні ліраглутиду спостерігалось значне зниження тяжкості обструктивного апное під час сну порівняно з плацебо, яке було оцінене за допомогою зменшення порівняно з плацебо (таблиця 4).
Таблиця 1
Дослідження 1: зміни маси тіла, глікемії та кардіометаболічних показників на 56-му тижні порівняно з вихідними величинами
|
Маса тіла |
Саксенда® (N = 2437) |
Плацебо (N = 1225) |
Саксенда® порівняно з плацебо |
|||
Вихідна маса тіла на візиті включення, кг (СВ) |
106,3 (21,2) |
106,3 (21,7) |
- |
|||
Середня зміна на 56-му тижні, % (95 % ДІ) |
8,0 |
2,6 |
5,4** (–5,8; –5,0) |
|||
Середня зміна на 56-му тижні, кг (95 % ДІ) |
8,4 |
2,8 |
5,6** (–6,0; –5,1) |
|||
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ) |
63,5 |
26,6 |
4,8** (4,1; 5,6) |
|||
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ) |
32,8 |
10,1 |
4,3** (3,5; 5,3) |
|||
Глікемія та кардіометаболічні фактори |
Вихідний показник на візиті включення |
Зміна |
Вихідний показник на візиті включення |
Зміна |
||
HbA1c, % |
5,6 |
0,3 |
5,6 |
0,1 |
0,23** (–0,25; –0,21) |
|
ГПН, ммоль/л |
5,3 |
0,4 |
5,3 |
0,01 |
0,38** (–0,42; –0,35) |
|
Систолічний артеріальний тиск, мм рт. ст. |
123,0 |
4,3 |
123,3 |
1,5 |
2,8** (–3,6; –2,1) |
|
Діастолічний артеріальний тиск, мм рт. ст. |
78,7 |
2,7 |
78,9 |
1,8 |
0,9* (–1,4; –0,4) |
|
Окружність талії, см |
115,0 |
8,2 |
114,5 |
4,0 |
4,2** (–4,7; –3,7) |
|
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 2
Дослідження 1: зміни маси тіла, глікемії та кардіометаболічних показників на 160-му тижні порівняно з вихідними величинами
|
Маса тіла |
Саксенда® (N = 1472) |
Плацебо (N = 738) |
Саксенда® порівняно з плацебо |
||
Вихідна маса тіла на візиті включення, кг (СВ) |
107,6 (21,6) |
108,0 (21,8) |
|||
Середня зміна на 160-му тижні, % (95 % ДІ) |
6,2 |
1,8 |
4,3** (–4,9; –3,7) |
||
Середня зміна на 160-му тижні, кг (95 % ДІ) |
6,5 |
2,0 |
4,6** (–5,3; –3,9) |
||
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 160-му тижні, % (95 % ДІ) |
49,6 |
23,4 |
3,2** (2,6; 3,9) |
||
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 160-му тижні, % (95 % ДІ) |
24,4 |
9,5 |
3,1** (2,3; 4,1) |
||
Глікемія та кардіометаболічні фактори |
Вихідний показник на візиті включення |
Зміна |
Вихідний показник на візиті включення |
Зміна |
|
HbA1c, % |
5,8 |
0,4 |
5,7 |
0,1 |
0,21** (–0,24; –0,18) |
ГПН, ммоль/л |
5,5 |
0,4 |
5,5 |
0,04 |
0,4** (–0,5; –0,4) |
Систолічний артеріальний тиск, мм рт. ст. |
124,8 |
3,2 |
125,0 |
0,4 |
2,8** (–3,8; –1,8) |
Діастолічний артеріальний тиск, мм рт. ст. |
79,4 |
2,4 |
79,8 |
1,7 |
0,6 (–1,3; 0,1) |
Окружність талії, см |
116,6 |
6,9 |
116,7 |
3,4 |
3,5** (–4,2; –2,8) |
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 160-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 160-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 3
Дослідження 2: зміни маси тіла, глікемії та кардіометаболічних показників на 56-му тижні порівняно з вихідними величинами
|
Маса тіла |
Саксенда® (N = 412) |
Плацебо (N = 211) |
Саксенда® порівняно з плацебо |
||
Вихідна маса тіла на візиті включення, кг (СВ) |
105,6 (21,9) |
106,7 (21,2) |
- |
||
Середня зміна на 56-му тижні, % (95 % ДІ) |
5,9 |
2,0 |
4,0** (–4,8; –3,1) |
||
Середня зміна на 56-му тижні, кг (95 % ДІ) |
6,2 |
2,2 |
4,1** (–5,0; –3,1) |
||
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ) |
49,8 |
13,5 |
6,4** (4,1; 10,0) |
||
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ) |
22,9 |
4,2 |
6,8** (3,4; 13,8) |
||
Глікемія та кардіометаболічні фактори |
Вихідний показник на візиті включення |
Зміна |
Вихідний показник на візиті включення |
Зміна |
|
HbA1c, % |
7,9 |
1,3 |
7,9 |
0,4 |
0,9** (–1,1; –0,8) |
ГПН, ммоль/л |
8,8 |
1,9 |
8,6 |
0,1 |
1,8** (–2,1; –1,4) |
Систолічний артеріальний тиск, мм рт. ст. |
128,9 |
3,0 |
129,2 |
0,4 |
2,6* (–4,6; –0,6) |
Діастолічний артеріальний тиск, мм рт. ст. |
79,0 |
1,0 |
79,3 |
0,6 |
0,4 (–1,7; 1,0) |
Окружність талії, см |
118,1 |
6,0 |
117,3 |
2,8 |
3,2** (–4,2; –2,2) |
Повна вибірка пацієнтів. Для маси тіла, HbA1c, ГПН, артеріального тиску та окружності талії наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
ГПН — глюкоза в плазмі натще.
СВ — стандартне відхилення.
Таблиця 4
Дослідження 3: зміни маси тіла та індексу апное-гіпопное на 32-му тижні порівняно з вихідними величинами
|
Маса тіла |
Саксенда® (N = 180) |
Плацебо (N = 179) |
Саксенда® порівняно з плацебо |
|||
Вихідна маса тіла на візиті включення, кг (СВ) |
116,5 (23,0) |
118,7 (25,4) |
- |
|||
Середня зміна на 32-му тижні, % (95 % ДІ) |
5,7 |
1,6 |
4,2** (–5,2; –3,1) |
|||
Середня зміна на 32-му тижні, кг (95 % ДІ) |
6,8 |
1,8 |
4,9** (–6,2; –3,7) |
|||
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 32-му тижні, % (95 % ДІ) |
46,4 |
18,1 |
3,9** (2,4; 6,4) |
|||
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 32-му тижні, % (95 % ДІ) |
22,4 |
1,5 |
19,0** (5,7; 63,1) |
|||
Вихідний показник на візиті включення |
Зміна |
Вихідний показник на візиті включення |
Зміна |
|||
Індекс апное-гіпопное, епізодів/годину |
49,0 |
12,2 |
49,3 |
6,1 |
6,1* (–11,0; –1,2) |
|
Повна вибірка пацієнтів. Для вихідних показників наведено середні величини, зміни на 32-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 32-му тижні є розрахунковими різницями між методами лікування (95 % ДІ). Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
* p < 0,05.
** p < 0,0001.
ДІ — довірчий інтервал.
СВ — стандартне відхилення.
Таблиця 5
Дослідження 4: зміна маси тіла на 56-му тижні порівняно з вихідною величиною
|
Маса тіла |
Саксенда® (N = 207) |
Плацебо (N = 206) |
Саксенда® порівняно з плацебо |
Вихідна маса тіла на візиті включення, кг (СВ) |
100,7 (20,8) |
98,9 (21,2) |
- |
Середня зміна на тижні 56, % (95 % ДІ) |
6,3 |
0,2 |
6,1** (–7,5; –4,6) |
Середня зміна на 56-му тижні, кг (95 % ДІ) |
6,0 |
0,2 |
5,9** (–7,3; –4,4) |
Відсоток пацієнтів, маса тіла яких зменшилась на ≥ 5 % на 56-му тижні, % (95 % ДІ) |
50,7 |
21,3 |
3,8** (2,4; 6,0) |
Відсоток пацієнтів, маса тіла яких зменшилась на > 10 % на 56-му тижні, % (95 % ДІ) |
27,4 |
6,8 |
5,1** (2,7; 9,7) |
Повна вибірка пацієнтів. Для вихідних показників наведено середні величини, зміни на 56-му тижні порівняно з вихідними показниками є розрахунковими середніми величинами (за методом найменших квадратів), і контрасти комбінацій умов на 56-му тижні є розрахунковими різницями між методами лікування. Для відсотка пацієнтів, маса тіла яких зменшилась на ≥ 5/> 10 %, наведено розрахункове співвідношення шансів. Пропущені значення після вихідного рівня були заміщені шляхом перенесення даних останнього спостереження вперед.
** p < 0,0001.
ДІ – довірчий інтервал.
СВ – стандартне відхилення.
Зміна маси тіла (%) |
|
Час, у тижнях |
|
□ Саксенда® ∆Плацебо ■▲ Перенос даних останнього дослідження |
|
Значення для пацієнтів, які завершують кожен плановий візит |
Рисунок 3. Зміна маси тіла (%) від рандомізації (тиждень 0) за часом у дослідженні 4
До тижня 0 пацієнтів лікували лише за допомогою дієти зі зниженою калорійністю та фізичних вправ. На тижні 0 пацієнти були рандомізовані для застосування або лікарського засобу Саксенда®, або плацебо.
Імуногенність
Враховуючи потенційні імуногенні властивості лікарських засобів, що містять білки або пептиди, можна передбачити, що в пацієнтів можуть утворитися антитіла до ліраглутиду після застосування лікарського засобу Саксенда®. Під час клінічних досліджень у 2,5 % пацієнтів, які отримували ліраглутид, утворювались антитіла до ліраглутиду. Утворення антитіл не призводило до зниження ефективності ліраглутиду.
Вплив на серцево-судинну систему
Основні серйозні несприятливі серцево-судинні явища (МАСЕ), які були визначені зовнішньою незалежною експертною групою: нелетальний інфаркт міокарда, нелетальний інсульт, серцево-судинна смерть. В усіх тривалих клінічних дослідженнях лікарського засобу Саксенда® було зареєстровано 6 МАСЕ у пацієнтів, які отримували ліраглутид, та 10 МАСЕ у пацієнтів, які отримували плацебо. Відношення ризиків та ДІ 95 % при порівнянні лікарського засобу Саксенда® та плацебо становило 0,33 [0,12; 0,90].
У клінічних дослідженнях 3-ї фази спостерігалось підвищення частоти серцевих скорочень порівняно з вихідним значенням в середньому на 2,5 удара за хвилину (від 1,6 до 3,6 удара за хвилину в окремих дослідженнях). Максимальне збільшення частоти серцевих скорочень спостерігалося приблизно після 6 тижнів терапії. Тривалий клінічний вплив збільшення частоти серцевих скорочень не встановлений. Це збільшення було зворотним та зникало після припинення терапії ліраглутидом (див. розділ «Особливості застосування»).
У дослідженні LEADER® брали участь 9340 пацієнтів із недостатньо контрольованим цукровим діабетом 2 типу. Переважна кількість із них страждали на серцево-судинні захворювання. Пацієнтів рандомізовано розподіляли для застосування ліраглутиду у добовій дозі до 1,8 мг (4668) або плацебо (4672) на додаток до стандартного лікування.
Тривалість терапії становила від 3,5 до 5 років. Середній вік пацієнтів становив 64 роки, середній ІМТ – 32,5 кг/м². Середнє значення початкового рівня HbA1c становило 8,7 і покращилося через 3 роки на 1,2 % у пацієнтів, яким був призначений ліраглутид, та на 0,8 % у пацієнтів, яким було призначено плацебо. Первинною кінцевою точкою ефективності був час від рандомізації до першого виникнення будь-яких основних MACE: нелетального інфаркту міокарда, нелетального інсульту, серцево-судинної смерті. Ліраглутид значно знизив частоту виникнення основних несприятливих серцево-судинних явищ (події первинної кінцевої точки, MACE) порівняно з плацебо (3,41 проти 3,90 на 100 пацієнто-років у групах ліраглутиду та плацебо відповідно), зменшивши ризик на 13 %, відношення ризиків (HR) – 0,87, [0,78; 0,97] [95 % ДІ]) (р = 0,005) (див. Рисунок 4).
Пацієнти з подією (%) |
Час від рандомізації (місяці) |
HR: 0,87 95 % ДІ 0,78; 0,97; р<0,001 для не меншої ефективності; р=0,005 для вищої ефективності |
|||||||||||
|
- - - - - - плацебо ліраглутид |
|||||||||||||
Пацієнтів у групі ризику |
|||||||||||||
Плацебо |
4672 |
4587 |
4473 |
4352 |
4237 |
4123 |
4010 |
3914 |
1543 |
407 |
|||
Ліраглутид |
4668 |
4593 |
4496 |
4400 |
4280 |
4172 |
4072 |
3982 |
1562 |
424 |
|||
FAS: Повний набір аналізів |
|||||||||||||
Рисунок 4. Графік Каплана — Маєра час до першої події MACE — популяція FAS
ДітиПодвійно сліпе дослідження ефективності і безпеки застосування лікарського засобу Саксенда® порівняно з плацебо для зниження маси тіла у пацієнтів дитячого віку від 12 років з ожирінням показало, що лікарський засіб Саксенда® є більш ефективним, ніж плацебо, для зниження маси тіла (яке оцінювалось за шкалою стандартного відхилення ІМТ або Z-score) через 56 тижнів лікування (табл. 6).
Серед пацієнтів, які приймали ліраглутид, більший відсоток пацієнтів досяг зниження ІМТ на ≥ 5 % та ≥ 10 %, ніж серед пацієнтів, які приймали плацебо. В середньому зниження ІМТ та маси тіла також було більшим у групі пацієнтів, які приймали ліраглутид (табл. 6). Після 26 тижнів періоду подальшого спостереження без застосування досліджуваного лікарського засобу спостерігалося відновлення маси тіла у пацієнтів, які приймали ліраглутид, порівняно з тими, хто приймав плацебо (табл. 6).
Таблиця 6
Дослідження 4180: зміни від вихідного рівня маси тіла та ІМТ на 56-му тижні та зміна за шкалою стандартного відхилення ІМТ (BMI SDS) від 56-го тижня до 82-го тижня
Саксенда® (N=125) |
Плацебо (N=126) |
Саксенда® порівняно з плацебо |
|
BMI SDS |
|||
Вихідний показник, BMI SDS (СВ) |
3,14 (0,65) |
3,20 (0,77) |
|
Середня зміна на 56-му тижні (95 % ДІ) |
0,23 |
0,00 |
0,22* (-0,37; -0,08) |
56-й тиждень, BMI SDS (СВ) |
2,88 (0,94) |
3,14 (0,98) |
|
Середня зміна від 56-го тижня до 82-го тижня, BMI SDS (95 % ДІ) |
0,22 |
0,07 |
0,15** (0,07; 0,23) |
Маса тіла |
|||
Вихідний показник, кг (СВ) |
99,3 (19,7) |
102,2 (21,6) |
- |
Середня зміна на 56-му тижні, % (95 % ДІ) |
2,65 |
2,37 |
5,01** (-7,63; -2,39) |
Середня зміна на 56-му тижні, кг (95 % ДІ) |
2,26 |
2,25 |
4,50** (-7,17; -1,84) |
ІМТ |
|||
Вихідний показник, кг/м2 (СВ) |
35,3 (5,1) |
35,8 (5,7) |
- |
Середня зміна на 56-му тижні, кг/м2 (95 % ДІ) |
1,39 |
0,19 |
1,58** (-2,47; -0,69) |
Відсоток пацієнтів зі зниженням на ≥ 5 % вихідного ІМТ на 56-му тижні, % (95 % ДІ) |
43,25 |
18,73 |
3,31** (1,78; 6,16) |
Відсоток пацієнтів зі зниженням на ≥ 10 % вихідного ІМТ на 56-му тижні, % (95 % ДІ) |
26,08 |
8,11 |
4,00** (1,81; 8,83) |
Повна вибірка пацієнтів. Для BMI SDS, маси тіла та ІМТ вихідні показники є середніми величинами, зміни від вихідного рівня на 56-му тижні є розрахованими середніми величинами (методом найменших квадратів), а відмінності в лікуванні на 56-му тижні – це розраховані різниці між методами лікування. Для BMI SDS показники на 56-му тижні є середніми величинами, зміни від 56-го тижня до 82-го тижня є розрахованими величинами (методом найменших квадратів), а відмінності в лікуванні на 82-му тижні – це розраховані різниці між методами лікування. Для частки пацієнтів, які втратили ≥ 5 % / ≥ 10 % вихідного ІМТ, також наведено розраховане співвідношення шансів. Пропущені спостереження інтерпольовані з групи пацієнтів, які приймали плацебо, на основі переходу до референційного підходу множинної (x100) підстановки даних.
* p < 0,01, ** p < 0,001. ДІ – довірчий інтервал. СВ – стандартне відхилення.
Відповідно до переносимості лікарського засобу 103 пацієнти (82,4 %) збільшили дозу та продовжували приймати дозу 3,0 мг, 11 пацієнтів (8,8 %) збільшили дозу та продовжували приймати дозу 2,4 мг, 4 пацієнти (3,2 %) збільшили дозу та продовжували приймати дозу 1,8 мг, 4 пацієнти (3,2 %) збільшили дозу та продовжували приймати дозу 1,2 мг і 3 пацієнти (2,4 %) продовжували приймати дозу 0,6 мг.
Через 56 тижнів лікування не було зареєстровано жодного впливу на ріст чи статеве дозрівання пацієнтів.
Дослідження з 16-тижневим подвійно сліпим періодом і 36-тижневим відкритим періодом було проведено для оцінки ефективності та безпеки застосування лікарського засобу Саксенда® педіатричним пацієнтам із синдромом Прадера – Віллі та ожирінням. Дослідження включало 32 пацієнти віком від 12 до 18 років (частина А) та 24 пацієнти віком від 6 до 12 років (частина В). Пацієнти були рандомізовані в співвідношенні 2:1 для прийому лікарського засобу Саксенда® або плацебо. Пацієнти з масою тіла менше 45 кг почали збільшувати дозу на меншу величину (0,3 мг замість 0,6 мг) та збільшували до максимальної дози 2,4 мг.
Розрахована різниця в лікуванні за середніми значеннями ІМТ SDS на 16 тижні (частина A: -0,20 проти -0,13, частина B: -0,50 проти -0,44) і на 52 тижні (частина A: -0,31 проти -0,17, частина B: -0,73 проти - 0,67) була подібною при застосуванні лікарського засобу Саксенда® та плацебо.
Жодних додаткових проблем щодо безпеки під час дослідження не було помічено.
Європейське агентство з лікарських засобів відклало зобов'язання подавати результати досліджень застосування лікарського засобу Саксенда® в одній або декількох підгрупах дитячого населення при лікуванні ожиріння та при лікуванні синдрому Прадера-Віллі (див. Розділ «Спосіб застосування та дози»).
Фармакокінетика.
Абсорбція
Абсорбція ліраглутиду після підшкірного введення відбувається повільно, максимальна концентрація досягається приблизно через 11 годин після введення. У пацієнтів, які страждають на ожиріння (ІМТ 30-40 кг/м2), після введення 3 мг ліраглутиду його середня рівноважна концентрація (AUCt/24) досягала приблизно 31 нмоль/л. Експозиція ліраглутиду збільшувалася пропорційно дозі. Абсолютна біодоступність ліраглутиду після підшкірного введення становить приблизно 55 %.
Розподіл
Середній видимий об’єм розподілу після підшкірного введення становить 20–25 л (для людини з масою тіла приблизно 100 кг). Ліраглутид значною мірою зв’язується з білками плазми крові (>98 %).
Метаболізм
Протягом 24 годин після введення разової дози [3H]-ліраглутиду здоровим добровольцям основним компонентом у плазмі крові був незмінений ліраглутид. У плазмі крові були виявлені в незначній кількості два метаболіти (≤ 9 % і ≤ 5 % від загального рівня радіоактивності у плазмі крові).
Виведення
Ліраглутид ендогенно метаболізується, як і всі великі білки, без участі специфічного органу як основного шляху елімінації. Після введення дози [3H]-ліраглутиду в сечі і калі не було виявлено незміненого ліраглутиду. Тільки невелика частка введеної радіоактивності у вигляді метаболітів ліраглутиду виводилась нирками та через кишечник (6 % і 5 % відповідно). Радіоактивні речовини виводяться нирками або через кишечник в основному протягом перших 6 – 8 діб у вигляді трьох метаболітів.
Після одноразового підшкірного введення ліраглутиду середнє значення кліренсу становить приблизно 0,9-1,4 л/годину, період напіввиведення – приблизно 13 годин.
Особливі групи пацієнтів
Пацієнти літнього віку
На підставі даних фармакокінетичного аналізу групи пацієнтів віком від 18 до 82 років з надмірною масою тіла чи ожирінням був зроблений висновок, що вік не має клінічно значущого впливу на фармакокінетику ліраглутиду. Тому немає необхідності в коригуванні дози відносно віку.
Стать
Дані фармакокінетичного аналізу показали, що у жінок спостерігається на 24 % нижчий кліренс ліраглутиду порівняно з чоловіками. На підставі цих даних можна зробити висновок, що корекція дози відносно статі не потрібна.
Етнічне походження
На підставі даних фармакокінетичного аналізу групи пацієнтів європеоїдної, монголоїдної, латиноамериканської і негроїдної рас з надмірною масою тіла чи ожирінням був зроблений висновок, що етнічне походження не виявляє будь-якого істотного клінічного впливу на фармакокінетику ліраглутиду.
Маса тіла
Експозиція ліраглутиду зменшується зі збільшенням початкової маси тіла. Як показали дослідження, добова доза ліраглутиду 3,0 мг забезпечує нормальний системний вплив на організм пацієнта з масою тіла 60-234 кг. Експозиція ліраглутиду у пацієнтів з масою тіла більше 234 кг не вивчалась.
Порушення функції печінки
Фармакокінетику ліраглутиду досліджували у пацієнтів із різним ступенем порушень функції печінки у процесі дослідження із застосуванням одноразової дози (0,75 мг). Було показано, що у пацієнтів з легкими і помірними порушеннями функції печінки експозиція ліраглутиду знижувалася на 13-23 % порівняно зі здоровими добровольцями. У пацієнтів з тяжкими порушеннями функції печінки (>9 балів за класифікацією Чайлда – П’ю) експозиція була значно нижча (на 44 %).
Порушення функції нирок
Експозиція ліраглутиду була знижена у пацієнтів з порушеннями функції нирок порівняно з особами з нормальною функцією нирок у процесі дослідження із застосуванням одноразової дози (0,75 мг). У пацієнтів з легкими порушеннями (кліренс креатиніну 50-80 мл/хв) експозиція знижувалася на 33 %, з порушеннями помірної тяжкості (кліренс креатиніну 30 – 50 мл/хв) – на 14 %, з тяжкими порушеннями (кліренс креатиніну <30 мл/хв) – на 27 %, а на кінцевих стадіях захворювань нирок, що вимагають проведення діалізу, – на 26 %.
Діти
Фармакокінетичні властивості ліраглутиду в дозі 3,0 мг було оцінено в ході клінічних досліджень за участю пацієнтів дитячого віку ≥ 12 років з ожирінням (134 пацієнти з масою тіла 62–178 кг).
Експозиція ліраглутиду у дітей ≥ 12 років була подібною до експозиції у дорослих з ожирінням.
Фармакокінетичні властивості також оцінювали у ході клініко-фармакологічного дослідження за участю пацієнтів дитячого віку 7–11 років з ожирінням (13 пацієнтів, маса тіла 54–87 кг) .
Було виявлено порівнянну експозицію при введенні 3,0 мг ліраглутиду у дорослих, дітей ≥ 12 років та дітей віком 7-11 років після корекції маси тіла.
Доклінічні дані з безпеки
Доклінічні дані, що базуються на дослідженнях з фармакологічної безпеки, токсичності повторних доз та генотоксичності, не виявили жодного ризику для людини.
У процесі дворічних досліджень канцерогенності у щурів та мишей були виявлені пухлини С-клітин щитоподібної залози, що не призводили до летального результату. Нетоксична доза (NOAEL) у щурів не була встановлена. У мавп, що отримували лікування протягом 20 місяців, таких пухлин не виявлено. Пухлини у гризунів обумовлені негенотоксичним специфічним ГПП-1-рецептор-опосередкованим механізмом, до якого частково чутливі гризуни. Значущість цього механізму у людей достатньо низька, але не може бути повністю виключена. Розвитку інших пухлин не було виявлено. У процесі досліджень на тваринах не було виявлено прямого шкідливого впливу на фертильність, проте при введенні найвищих доз відзначалося незначне підвищення ранньої ембріональної летальності. Введення ліраглутиду в період середини вагітності спричиняло зниження маси тіла самки, уповільнення росту плода з нез’ясованим впливом на розвиток ребер у щурів і скелета у кроликів. При введенні ліраглутиду відзначено уповільнення росту новонароджених щурів, що зберігається в період відлучення від годування молоком у групі прийому високої дози. Невідомо, чи уповільнення росту новонароджених щурів обумовлене зниженням споживання ними молока в результаті прямого впливу ГПП-1, чи зменшенням молока у матері, що обумовлено зниженням калорійності споживаної їжі.
У ювенільних щурів застосування ліраглутиду призводило до затримки статевого дозрівання як самців, так і самок за клінічно значимих концентрацій препарату в плазмі крові. Такі затримки не впливали на фертильність і репродуктивну здатність самок та самців чи на здатність самок виношувати вагітність.
ПоказанняЛікарський засіб Саксенда® застосовують для зменшення маси тіла як доповнення до дієти зі зниженою калорійністю та збільшеною фізичною активністю у дорослих пацієнтів з початковим індексом маси тіла (ІМТ) більше 30 кг/м2 (ожиріння) або від 27 до 30 кг/м2 (надмірна маса тіла) за наявності хоча б одного супутнього захворювання, пов’язаного з масою тіла, такого як дисглікемія (переддіабет або цукровий діабет 2 типу), гіпертензія, дисліпідемія або обструктивне апное сну.
Якщо через 12 тижнів після прийому добової дози 3,0 мг пацієнт не втратив щонайменше 5 % від початкової маси тіла, застосування лікарського засобу Саксенда® слід припинити.
Діти ≥ 12 років
Лікарський засіб Саксенда® можна застосовувати як доповнення до здорового харчування та збільшеної фізичної активності для корекції маси тіла у пацієнтів дитячого віку від 12 років із:
ожирінням (ІМТ ≥ 30 кг/м2 для дорослих пацієнтів за міжнародними гранично допустимими значеннями)* та
масою тіла більш ніж 60 кг.
Лікування препаратом Саксенда® слід припинити і переглянути, якщо пацієнт не втратив щонайменше 4 % свого ІМТ або ІМТ за оцінкою Z-score через 12 тижнів застосування препарату в дозі 3,0 мг/добу чи в максимальній переносимій дозі.
* Гранично допустимі значення ІМТ, встановлені Міжнародною робочою групою з вивчення ожиріння, для пацієнтів віком 12–18 років із ожирінням у розбивці за статтю (див. табл. 7).
Таблиця 7
Гранично допустимі значення ІМТ, встановлені Міжнародною робочою групою з вивчення ожиріння, для пацієнтів із ожирінням у віці 12–18 років у розбивці за статтю
Вік (років) |
ІМТ, який відповідає 30 кг/м2 для дорослих пацієнтів за міжнародними гранично допустимими значеннями |
|
Хлопці |
Дівчата |
|
12 |
26,02 |
26,67 |
12,5 |
26,43 |
27,24 |
13 |
26,84 |
27,76 |
13,5 |
27,25 |
28,20 |
14 |
27,63 |
28,57 |
14,5 |
27,98 |
28,87 |
15 |
28,30 |
29,11 |
15,5 |
28,60 |
29,29 |
16 |
28,88 |
29,43 |
16,5 |
29,14 |
29,56 |
17 |
29,41 |
29,69 |
17,5 |
29,70 |
29,84 |
18 |
30,00 |
30,00 |
Підвищена чутливість до діючої речовини або до інших компонентів лікарського засобу.
Взаємодія з іншими лікарськими засобами та інші види взаємодіїІn vitro ліраглутид продемонстрував дуже низький потенціал впливу на фармакокінетику інших активних субстанцій, обмін яких пов’язаний із цитохромом Р450, а також зв’язування з білками плазми крові.
Ліраглутид спричинює незначну затримку випорожнення шлунка, що може вплинути на всмоктування пероральних препаратів, що застосовуються одночасно. Дослідження щодо взаємодії не показали будь-якого клінічно значущого уповільнення всмоктування, тому корекція дози не потрібна.
Дослідження взаємодії проводили при застосуванні ліраглутиду в дозі 1,8 мг. Вплив на швидкість випорожнення шлунка був еквівалентним до ліраглутиду в дозі 1,8 мг та 3,0 мг (парацетамол AUC0-300 хв). Зареєстрований щонайменше один епізод виникнення гострої діареї у деяких пацієнтів, які отримували лікарський засіб Саксенда®. Діарея може порушувати всмоктування пероральних лікарських засобів, що одночасно приймаються.
Варфарин та інші похідні кумарину
Досліджень лікарської взаємодії не проводили. Не можна виключити клінічно значущу взаємодію з активною субстанцією, що має низьку розчинність або вузький терапевтичний індекс, такою як варфарин. На початку лікування ліраглутидом у пацієнтів, які одержують варфарин або інші похідні кумарину, рекомендується частіше проводити контроль міжнародного нормалізованого співвідношення (МНС).
Парацетамол
Ліраглутид не змінював загальну експозицію парацетамолу після введення одноразової дози 1000 мг. Максимальна концентрація парацетамолу (Cmax) знижувалася на 31 %, а медіана часу досягнення максимальної концентрації (tmax) збільшувалася до 15 хвилин. При одночасному застосуванні парацетамолу корекція дози не потрібна.
Аторвастатин
Ліраглутид не змінював загальну експозицію аторвастатину до клінічно значущого рівня після одноразового його введення в дозі 40 мг. У зв’язку з цим при одночасному застосуванні з ліраглутидом корекція дози аторвастатину не потрібна. При одночасному введенні з ліраглутидом Cmax аторвастатину знижувалася на 38 %, а медіана tmax збільшувалася з 1 години до 3 годин.
Гризеофульвін
Ліраглутид не змінював загальної експозиції гризеофульвіну після одноразового його введення в дозі 500 мг. Cmax гризеофульвіну зростала на 37 %, тоді як медіана tmax не змінювалася. Коригування дози гризеофульвіну та інших низькорозчинних сполук з високою проникністю не потрібне.
Дигоксин|
Після одноразового введення 1 мг дигоксину у поєднанні з ліраглутидом відмічено зменшення значення площі під кривою «концентрація-час» (AUC) для дигоксину на 16 %; Cmax знижувалася на 31 %. Медіана tmax дигоксину збільшувалася з 1 години до 1,5 години. Виходячи з даних результатів, корекція дози дигоксину не потрібна.
Лізиноприл
Після одноразового застосування 20 мг лізиноприлу з ліраглутидом відмічено зменшення AUC для лізиноприлу на 15 %, Cmax знижувалася на 27 %. Медіана tmax лізиноприлу збільшувалася з 6 до 8 годин. Виходячи з даних результатів, корекція дози лізиноприлу не потрібна.
Пероральні контрацептиви
При одночасному застосуванні разової дози пероральних контрацептивів ліраглутид знижував Cmax етинілестрадіолу або левоноргестрелу на 12 % і 13 % відповідно, а tmax збільшувався на 1,5 години. Це не мало клінічно значущого впливу на загальну експозицію етинілестрадіолу або левоноргестрелу, що дає підставу вважати, що одночасний прийом їх з ліраглутидом не вплине на контрацептивний ефект етинілестрадіолу та левоноргестрелу.
Діти
Дослідження лікарської взаємодії проводились лише за участю дорослих пацієнтів.
Особливості щодо застосуванняСпостереження
З метою покращення спостереження за біологічними лікарськими засобами, назва та номер серії препарату, що вводиться, повинні бути чітко записані.
Аспірація в поєднанні із загальною анестезією або глибокою седацією
У пацієнтів, які отримували агоністи рецепторів ГПП-1, спостерігалися випадки легеневої аспірації під час їх перебування під загальною анестезією або у стані глибокої седації. Тому перед виконанням процедури із використанням загальної анестезії або глибокої седації слід враховувати підвищений ризик наявності залишкового вмісту шлунка внаслідок затримки випорожнення шлунка (див. розділ «Побічні реакції»).
Серцева недостатність
Немає клінічного досвіду лікування пацієнтів із застійною серцевою недостатністю IV класу за класифікацією Нью-Йоркської асоціації кардіологів (NYHA), тому ліраглутид не рекомендовано застосовувати цим пацієнтам.
Особливі групи пацієнтів
Безпека та ефективність застосування ліраглутиду для корекції маси тіла не встановлені у пацієнтів:
віком ≥ 75 років;
які застосовують інші лікарські засоби для корекції маси тіла;
із вторинним ожирінням, викликаним ендокринологічними розладами чи розладами, пов’язаними з харчуванням, або в результаті застосування лікарських засобів, що можуть спричинити збільшення маси тіла;
з тяжким порушенням функції нирок;
з тяжким порушенням функції печінки.
Не рекомендується застосовувати лікарський засіб Саксенда® даним групам пацієнтів (див. розділ «Дозування»).
Оскільки дослідження щодо застосування ліраглутиду для корекції маси тіла в пацієнтів з легкими або помірними порушеннями функції печінки відсутні, його слід з обережністю застосовувати цій групі пацієнтів (див. розділи «Фармакокінетика» та «Дозування»).
Досвід застосування ліраглутиду у пацієнтів із запальними захворюваннями кишечнику і діабетичним гастропарезом обмежений. Застосування ліраглутиду цим пацієнтам не рекомендовано, оскільки воно супроводжується тимчасовими побічними реакціями з боку шлунково-кишкового тракту, в т. ч. нудотою, блюванням і діареєю.
Панкреатит
Спостерігались випадки гострого панкреатиту при застосуванні аналогів рецептора ГПП-1.
Пацієнтів слід проінформувати про характерні симптоми гострого панкреатиту. При підозрі на панкреатит слід відмінити лікування ліраглутидом. Якщо підтверджується гострий панкреатит, повторне застосування ліраглутиду не рекомендоване.
Жовчнокам’яна хвороба та холецистит
У клінічних випробуваннях у пацієнтів, які застосовували ліраглутид для зменшення маси тіла, спостерігалася більша частота виникнення жовчнокам’яної хвороби та холециститу порівняно з пацієнтами, які отримували плацебо. Той факт, що швидка втрата маси тіла може збільшити ризик розвитку жовчнокам’яної хвороби і, отже, холециститу, лише частково пояснює більш високу частоту виникнення даних захворювань при застосуванні ліраглутиду. Жовчнокам’яна хвороба та холецистит можуть призвести до госпіталізації та холецистектомії. Пацієнтів слід поінформувати про характерні симптоми жовчнокам’яної хвороби та холециститу.
Захворювання щитоподібної залози
У процесі клінічних досліджень цукрового діабету 2 типу відмічені побічні реакції з боку щитоподібної залози, такі як зоб, особливо у пацієнтів з уже наявними захворюваннями щитоподібної залози. Тому ліраглутид слід з обережністю застосовувати цим пацієнтам.
Частота серцевих скорочень
Під час клінічних досліджень ліраглутиду спостерігалося збільшення частоти серцевих скорочень (див. розділ «Фармакодинаміка»). Частоту серцевих скорочень слід контролювати через рівні проміжки часу відповідно до звичайної клінічної практики. Пацієнтів слід проінформувати про симптоми збільшення частоти серцевих скорочень (підвищене серцебиття або відчуття підвищеного серцебиття в спокої). Пацієнтам, у яких спостерігається клінічно значуще стійке збільшення частоти серцевих скорочень у спокої, лікування ліраглутидом слід припинити.
Зневоднення
У пацієнтів, які застосовували агоністи рецепторів ГПП-1, спостерігалися симптоми зневоднення, в тому числі порушення функції нирок та гострої ниркової недостатності. Пацієнтів, яким призначено ліраглутид, необхідно проінформувати про можливість зневоднення організму внаслідок розладів травної системи та необхідність вживання запобіжних заходів щодо зневоднення.
Гіпоглікемія у пацієнтів з цукровим діабетом 2 типу
У пацієнтів із цукровим діабетом 2 типу, які отримують ліраглутид одночасно з інсуліном та/або сульфонілсечовиною, може бути підвищений ризик виникнення гіпоглікемії. Ризик виникнення гіпоглікемії може бути знижений за допомогою зменшення дози інсуліну та/або сульфонілсечовини.
Діти
У дітей ≥ 12 років, які отримували лікування ліраглутидом, повідомлялося про епізоди клінічно значущої гіпоглікемії. Пацієнтів слід проінформувати про характерні симптоми гіпоглікемії та відповідні заходи.
Гіперглікемія у пацієнтів з цукровим діабетом 2 типу, які отримують інсулін
У пацієнтів з цукровим діабетом 2 типу лікарський засіб Саксенда® не можна застосовувати як заміну інсуліну. Повідомлялося про розвиток діабетичного кетоацидозу у інсулінозалежних пацієнтів у разі швидкого припинення застосування або зменшення дози інсуліну (див. розділ «Спосіб застосування та дози»).
Допоміжні речовини
Саксенда® містить менше ніж 1 ммоль натрію (23 мг), тому лікарський засіб можна вважати таким, що не містить натрію.
Застосування у період вагітності або годування груддю.Вагітність
Адекватні дані щодо застосування ліраглутиду вагітним жінкам відсутні. Дослідження на тваринах показали репродуктивну токсичність (див. розділ «Доклінічні дані з безпеки»). Потенційний ризик для людей невідомий.
Ліраглутид не слід застосовувати під час вагітності. Якщо пацієнтка хоче завагітніти або вагітна, то прийом ліраглутиду необхідно відмінити.
Період годування груддю
Невідомо, чи екскретується ліраглутид у грудне молоко людини. Дослідження на тваринах показали, що в молоко потрапляє незначна кількість ліраглутиду і його близькоспоріднених структурних метаболітів. Доклінічні дослідження виявили пов’язане із застосуванням препарату зменшення темпів зростання новонароджених щуренят (див. розділ «Доклінічні дані про безпеку застосування»). У зв’язку з недостатнім досвідом застосування препарату у період годування груддю не слід застосовувати його в цей період.
Фертильність
Окрім незначного зменшення кількості живих імплантованих ембріонів, дослідження на тваринах не виявили шкідливого впливу препарату на репродуктивну здатність (див. розділ «Доклінічні дані про безпеку застосування»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.Лікарський засіб Саксенда® не впливає або має незначний вплив на здатність керувати транспортними засобами й іншими механізмами. Однак може виникати запаморочення здебільшого протягом перших 3 місяців лікування лікарським засобом Саксенда®. Слід з обережністю керувати автотранспортом або іншими механізмами при виникненні запаморочення.
Спосіб застосування та дози ДозуванняДорослі
Початкова доза становить 0,6 мг на добу. Для поліпшення переносимості з боку шлунково-кишкового тракту дозу слід підвищувати щотижня на 0,6 мг до досягнення добової дози 3,0 мг (див. таблицю 8).
У разі поганої переносимості наступної підвищеної дози протягом двох послідовних тижнів слід розглянути питання про припинення лікування. Добова доза вище 3,0 мг не рекомендується.
Таблиця 8
Графік підвищення дози
Доза, мг |
Тижні |
|
Збільшення дози протягом 4 тижнів |
0,6 |
1 |
1,2 |
1 |
|
1,8 |
1 |
|
2,4 |
1 |
|
Підтримуюча доза |
3,0 мг |
|
Діти ≥ 12 років
Для дітей віком від 12 років слід застосовувати таку ж схему підвищення дози, як і для дорослих (див. таблицю 8). Дозу слід збільшувати до досягнення 3,0 мг (підтримуюча доза) або максимальної переносимої дози. Добові дози вище 3,0 мг не рекомендуються.
Пропущена доза
Якщо ін’єкція пропущена протягом 12 годин з моменту її звичайного введення, пацієнт повинен прийняти дозу якнайшвидше. Якщо до наступного введення залишається менше 12 годин, пацієнт не повинен приймати пропущену дозу, а продовжувати режим прийому 1 раз на добу – прийняти наступну заплановану дозу препарату. Не слід приймати додаткову дозу чи збільшувати дозу для компенсації пропущеної ін’єкції.
Пацієнти з цукровим діабетом 2 типу
Лікарський засіб Саксенда® не слід застосовувати в комбінації з іншими агоністами рецепторів ГПП-1. Для зниження ризику розвитку гіпоглікемії на початку застосування лікарського засобу Саксенда® слід розглянути можливість зменшення дози одночасно застосовуваних інсуліну або стимуляторів секреції інсуліну (наприклад, сульфонілсечовини). Необхідний самоконтроль рівня глюкози в крові для коригування дози інсуліну чи стимуляторів секреції інсуліну (див. розділ «Особливості застосування»).
Особливі групи пацієнтів
Пацієнти літнього віку (≥65 років)
Корекція дози у зв’язку з віком не потрібна. Досвід застосування препарату пацієнтам ≥75 років обмежений, тому не рекомендовано застосовувати його даній категорії пацієнтів (див. розділи «Фармакокінетика» та «Особливості застосування»).
Пацієнти з порушеннями функції нирок
Корекція дози не потрібна у пацієнтів з легким або середнім ступенем порушення функції нирок (кліренс креатиніну ≥30 мл/хв). Не рекомендується застосовувати лікарський засіб Саксенда® пацієнтам з тяжким порушенням функції нирок (кліренс креатиніну <30 мл/хв), включаючи пацієнтів із термінальною стадією порушення функції нирок (див. розділи «Фармакокінетика», «Особливості застосування» та «Побічні реакції»).
Пацієнти з порушеннями функції печінки
Не рекомендується коригування дози пацієнтам з легким або середнім ступенем порушення функції печінки. Застосування лікарського засобу Саксенда® не рекомендується пацієнтам з тяжким порушенням функції печінки, а пацієнтам із легким або помірним порушенням функції печінки препарат слід застосовувати з обережністю (див. розділи «Фармакокінетика» та «Особливості застосування»).
Спосіб введення
Лікарський засіб Саксенда® призначений тільки для підшкірного введення. Його не можна вводити внутрішньовенно або внутрішньом’язово.
Препарат вводять підшкірно 1 раз на добу у будь-який час незалежно від вживання їжі. Його можна вводити підшкірно в ділянку передньої черевної стінки, стегна або плеча. Місце і час введення можна змінювати без корекції дози, проте бажано вводити приблизно в один і той же найбільш зручний час.
Нижче наводиться інструкція з використання шприц-ручки для введення лікарського засобу.
З метою зменшення ризику утворення відкладень амілоїдози при ін’єкції, необхідно завжди змінювати місце ін’єкції (див. розділ «Побічні рекації»).
Інструкція з використання шприц-ручки Саксенда®
Перед використанням шприц-ручки Саксенда® необхідно уважно причитати цю інструкцію.
Не користуватися шприц-ручкою без отримання належної інформації щодо її використання від лікаря чи медсестри.
Застосування препарату необхідно почати з перевірки шприц-ручки, щоб бути впевненим, що вона містить саме лікарський засіб Саксенда®, 6 мг/мл. Потім потрібно подивитися рисунки нижче, щоб дізнатися про різні частини шприц-ручки та голки.Незрячим пацієнтам та пацієнтам з поганим зором не можна користуватися шприц-ручкою без сторонньої допомоги. Допомагати має людина з хорошим зором, яка може побачити лічильник дози на шприц-ручці Саксенда® та яка вміє користуватися нею.
Шприц-ручка Саксенда® є попередньо заповненою. Вона містить 18 мг ліраглутиду, що дає змогу ввести дози 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг та 3,0 мг. Шприц-ручка Саксенда® призначена для використання з одноразовими голками НовоФайн® або НовоТвіст® довжиною до 8 мм і товщиною 32G. Голки не входять у комплект.
Важлива інформація
Необхідно звернути особливу увагу на цю позначку, оскільки вона є важливою для безпечного користування шприц-ручкою.
Шприц-ручка Саксенда® та голка (приклад)
1. Підготовка шприц-ручки з новою голкою для використання ;Перевірте назву та кольорову етикетку Вашої шприц-ручки, щоб бути впевненим, що вона містить лікарський засіб Саксенда®. Це особливо важливо в тому випадку, якщо Ви застосовуєте різні ін’єкційні лікарські засоби. Застосування неправильного лікарського засобу може бути шкідливим для Вашого здоров’я. ;Зніміть ковпачок шприц-ручки. |
|
|
;Переконайтеся, що розчин у шприц-ручці прозорий та безбарвний. Подивіться у вікно шкали картриджа. Якщо препарат мутний, шприц-ручку використовувати заборонено. |
|
|
;Візьміть нову одноразову голку та видаліть з неї захисну мембрану. |
|
|
;Переконайтеся, що голка прикріплена правильно. ;Нагвинтіть голку на шприц-ручку та поверніть її, щоб голка щільно трималась на шприц-ручці. |
|
|
;Голка закрита двома ковпачками. Ви повинні зняти обидва ковпачки. Якщо ви забудете зняти обидва ковпачки, ви не зробите ін’єкцію розчину. ;Зніміть зовнішній ковпачок голки та збережіть його. Він знадобиться після завершення ін’єкції для безпечного зняття голки. |
|
|
;Зніміть внутрішній ковпачок голки та викиньте його. Якщо Ви спробуєте надіти внутрішній ковпачок знову на голку, то можете поранитись. На кінці голки може з’явитися крапля розчину. Це нормальне явище, проте необхідно перевірити надходження препарату при використанні нової шприц-ручки вперше. Не приєднуйте нову голку до тих пір, поки не будете готові зробити ін’єкцію.
|
|
2. Перевірка потоку розчину з кожної нової шприц-ручки Якщо Ви вже використовували цю шприц-ручку, переходьте до пункту 3 «Виставлення дози». Перевіряйте потік розчину лише перед першим застосуванням нової шприц-ручки. Повертайте селектор дози до символу перевірки потоку ( |
|
|
Тримайте шприц-ручку голкою вгору. Натисніть і потримайте кнопку дози, поки лічильник дози не повернеться до «0». Значення «0» повинно відповідати покажчику дози. На кінчику голки повинна з’явитися крапля розчину. На кінчику голки може залишитися невелика крапля, але вона не буде вводитися. Якщо жодна крапля не з’явилася, поверніться до пункту 2 «Перевірка потоку розчину з нової шприц-ручки» до 6 разів. Якщо краплі все ще немає, змініть голку і повторіть дії, описані у пункті 2 «Перевірка потоку розчину з нової шприц-ручки» ще раз. Якщо крапля все-таки не з’явилася, утилізуйте ручку і використовуйте нову.
Якщо крапля не з’явиться, не використовуйте шприц-ручку, навіть якщо лічильник дози змінює значення. Це може вказувати на заблоковану або пошкоджену голку. Якщо Ви не перевірите потік перед першою ін’єкцією нової ручки, то можете не отримати необхідну дозу розчину для забезпечення бажаної дії лікарського засобу Саксенда®. |
|
3. Виставлення дози ;Повертайте селектор дози, поки лічильник дози не покаже необхідну дозу (0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг або 3,0 мг). Якщо Ви вибрали неправильну дозу, можна повернути селектор дози вперед або назад до правильної дози. Шприц-ручка вміщує максимум 3,0 мг препарату. За допомогою селектора можна змінити дозу. Тільки лічильник дози та показник дози покажуть, яку кількість міліграмів Ви вибираєте для ін’єкції. Ви можете вибрати до 3,0 мг лікарського засобу на дозу. Якщо шприц-ручка містить менше 3,0 мг, лічильник дози зупиняється до значення 3,0 мг. Чути різне клацання селектора дози при обертанні вперед, назад або при виставленні залишкової кількості розчину. Не рахуйте клацання.
Не рахуйте кількість клацань шприц-ручки. Не використовуйте шкалу картриджа. Вона показує приблизну кількість розчину, яка залишилась у шприц-ручці. За допомогою селектора дози повинні бути виставлені лише дози 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг або 3,0 мг. Цифри на дисплеї повинні точно збігатися з покажчиком дози, щоб забезпечити правильну дозу для введення. |
|
Залишок розчину в шприц-ручці ;Шкала шприц-ручки показує приблизно, скільки розчину залишилось у шприц-ручці. |
|
|
;Щоб точно побачити, скільки розчину залишилось, скористайтеся лічильником дози: Повертайте селектор дози вліво, поки лічильник дози не зупиниться. Якщо він показує 3,0, у шприц-ручці залишилося щонайменше 3,0 мг. Якщо лічильник дози зупиняється до 3,0 мг, значить у шприц-ручці не вистачає розчину для повної дози 3,0 мг. Якщо Вам потрібна вища доза, ніж та, що залишилася у Вашій шприц-ручці. Ви можете розділити свою дозу між Вашою поточною шприц-ручкою та новою шприц-ручкою тільки за умови, що Вас проінструктував лікар або медсестра. Використовуйте калькулятор, щоб спланувати дози згідно з інструкціями лікаря або медсестри. Будьте дуже обережні, щоб правильно розрахувати дозу. Будьте дуже уважні, розраховуючи дозу. Якщо Ви не впевнені, як розділити дозу за допомогою двох шприц-ручок, виберіть і введіть необхідну дозу новою шприц-ручкою. |
|
4. Введення дози ;Введіть голку під шкіру так, як показав Вам лікар чи медсестра. ;Переконайтеся, що Ви бачите лічильник дози. Не закривайте лічильник пальцями. Це може перервати ін’єкцію. |
|
|
Натисніть і утримуйте пускову кнопку. Спостерігайте, поки лічильник дози не повернеться до «0». «0» повинен збігатися з покажчиком дози. Потім Ви можете почути або відчути клацання. ;Продовжуйте натискати пускову кнопку, утримуючи голку під шкірою. |
|
|
Рахуйте повільно до 6, утримуючи натиснутою пускову кнопку. Якщо голку витягти раніше, Ви можете побачити потік розчину з кінчика голки. В такому випадку правильна доза не буде введена. |
|
|
Витягніть голку з-під шкіри. Після цього можна відпустити пускову кнопку. Якщо крапля крові з’явилась у місці ін’єкції, легенько притисніть це місце. Ви можете побачити краплю розчину на кінчику голки після введення. Це нормально і не впливає на об’єм введеної дози. Завжди дивіться на покажчик дози, щоб бачити скільки міліграмів розчину Ви ввели. Тримайте натиснутою пускову кнопку, поки покажчик дози не покаже знову «0». Як виявити заблоковану чи пошкоджену голку? Якщо «0» не відображається на лічильнику дози після постійного натискання пускової кнопки, можливо, Ви використали заблоковану або пошкоджену голку. У цьому випадку Ви не ввели потрібну кількість лікарського засобу, навіть незважаючи на те, що лічильник дози перемістився від раніше встановленої дози. Як поводитися із заблокованою голкою? Зніміть голку, як описано в пункті 5 «Після ін’єкції» і повторіть дії, описані в усіх пунктах, починаючи з пункту 1 «Підготовка шприц-ручки з новою голкою для використання» Ніколи не торкайтеся лічильника під час введення лікарського засобу. Це може перервати ін’єкцію. |
|
5. Після ін’єкції ;Завжди утилізуйте голку після кожної ін’єкції, щоб забезпечити зручність ін’єкції та запобігти використанню заблокованої голки. Якщо голка заблокована, Ви не зможете ввести лікарський засіб. Покладіть зовнішній ковпачок голки на пласку поверхню і надіньте зовнішній ковпачок на голку, не торкаючись голки та зовнішнього ковпачка голки |
|
|
Як тільки голка накривається, обережно повністю натисніть на зовнішній ковпачок голки. Обережно викрутіть голку та утилізуйте за інструкціями, отриманими від лікаря, медсестри, фармацевта, або відповідно до місцевих правил. |
|
|
Закривайте кришкою шприц-ручку після кожного використання, щоб захистити розчин від світла. Коли ручка порожня, викиньте її без голки за інструкціями, отриманими від лікаря, медсестри, фармацевта, або відповідно до місцевих правил. Ніколи не намагайтеся надіти внутрішній ковпачок голки назад на голку. Ви можете поранитися голкою. Завжди виймайте голку з ручки після кожної ін’єкції. Це може запобігти заблокуванню голки, забрудненню, зараженню, протіканню розчину та неточному дозуванню. |
|
Важлива інформація Завжди тримайте шприц-ручку та голки в недоступному місці для інших людей, особливо дітей. Ніколи не передавайте Вашу особисту шприц-ручку чи голки іншим людьми. Люди, що доглядають, мають бути дуже обережними при роботі з використаними голками, щоб запобігти травмуванню голкою та перехресному зараженню. |
|
Догляд за Вашою шприц-ручкою Не залишайте Вашу шприц-ручку в машині чи іншому місці, де може бути дуже жарко або занадто холодно. Не вводити лікарський засіб Саксенда®, який був заморожений. У такому разі ви можете не отримати очікуваного лікувального ефекту від цього препарату. Зберігайте шприц-ручку від пилу, бруду та рідин. Не мийте, не замочуйте та не змащуйте шприц-ручку. Її можна очистити за допомогою тканини, змоченої м’яким миючим засобом. Запобігайте падінню та ударам шприц-ручки об тверді поверхні. В разі падіння чи удару приєднайте нову голку і перевірте подачу розчину перед введенням. Не намагайтеся повторно наповнити шприц-ручку. Утилізуйте шприц-ручку після закінчення в ній розчину. Не намагайтеся самостійно полагодити шприц-ручку або розібрати її на частини. |
Діти
Для дітей віком від 12 років корекція дози не потрібна. Безпеку та ефективність застосування лікарського засобу Саксенда® дітям віком до 12 років не встановлено (див. розділ «Фармакодинаміка»).
ПередозуванняУ клінічних дослідженнях та протягом постмаркетингового застосування лікарського засобу Саксенда® повідомлялося про випадки передозування до 72 мг (у 24 рази більше рекомендованої підтримуючої дози). Події, про які повідомлялося, включали сильну нудоту, сильне блювання та тяжку гіпоглікемію.
У разі передозування слід розпочати підтримуюче лікування відповідно до наявних у пацієнта клінічних ознак і симптомів. Необхідно спостерігати за станом пацієнта щодо клінічних ознак зневоднення та контролювати рівень глюкози в крові.
Побічні ефектиРезюме профілю безпеки
Безпека застосування лікарського засобу Саксенда® була оцінена у 5 подвійно сліпих рандомізованих плацебо-контрольованих клінічних дослідженнях за участю 5813 дорослих пацієнтів з ожирінням або надмірною масою тіла із хоча б одним супутнім захворюванням, пов’язаним з надмірною масою тіла. Загалом найбільш частими побічними реакціями були розлади травної системи (67,9 %) (див. розділ «Опис окремих побічних реакцій»).
Список побічних реакцій
Нижче зазначені побічні реакції, про які повідомлялося у дорослих. Побічні реакції класифіковані за системами органів та частотою виникнення. Оцінку частоти виникнення побічних реакцій проводили за такою шкалою: дуже часто (≥ 1/10), часто (від ≥ 1/100 до < 1/10), нечасто (від ≥ 1/1000 до < 1/100), рідко (від ≥ 1/10000 до < 1/1000), дуже рідко (< 1/10000) та частота невідома (не можна визначити на основі наявних даних). У кожній групі побічні реакції наведені в порядку зниження їх серйозності.
З боку імунної системи: рідко – анафілактичні реакції.
Порушення метаболізму і харчування: часто – гіпоглікемія*; нечасто – зневоднення.
Психічні розлади: часто – безсоння**.
З боку нервової системи: дуже часто – головний біль; часто – запаморочення, дисгевзія.
З боку серцево-судинної системи: нечасто – тахікардія.
З боку травної системи: дуже часто – нудота, блювання, діарея, запор; часто - сухість у роті, диспепсія, гастрит, гастроезофагеальна рефлюксна хвороба, біль у верхньому відділі черевної порожнини, метеоризм, еруктація, здуття живота; нечасто – панкреатит***, затримка випорожнення шлунка****; частота невідома – кишкова непрохідність†.
З боку печінки та жовчних шляхів: часто – жовчнокам’яна хвороба***; нечасто – холецистит***.
З боку шкіри та підшкірних тканин: часто – висип, нечасто – кропив’янка, невідомо – амілоїдоз шкіри.
З боку нирок та сечовивідних шляхів: рідко – гостра ниркова недостатність, порушення функції нирок.
Загальні розлади та реакції в місці ін’єкції: часто – реакції в місцях ін’єкцій, астенія, втома; нечасто – нездужання.
Лабораторні дослідження: часто – підвищений рівень ліпази, підвищений рівень амілази.
* Гіпоглікемія (базується на симптомах, про які повідомляли самі пацієнти і які не підтверджені вимірюваннями рівня глюкози в крові) виникала у пацієнтів, які не страждають на цукровий діабет 2 типу та які застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю. Для отримання додаткової інформації див. розділ «Опис окремих побічних реакцій».
** Безсоння, в основному спостерігалося протягом перших 3 місяців лікування.
*** Див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій».
**** З контрольованої фази 2, За та Зб клінічних досліджень.
† Побічні реакції, відомі з постмаркетингового досвіду.
Опис окремих побічних реакційГіпоглікемія в пацієнтів, які не страждають на цукровий діабет 2 типу
У процесі клінічних випробувань не було зафіксованого жодного тяжкого випадку виникнення гіпоглікемії (що потребує сторонньої допомоги) у пацієнтів з надмірною масою тіла чи ожирінням, які не страждали на цукровий діабет 2 типу та застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю. Про виникнення симптомів гіпоглікемії повідомили 1,6 % пацієнтів, які отримували лікарський засіб Саксенда®, та 1,1 % пацієнтів, які отримували плацебо. Однак ці випадки не були підтверджені вимірюванням рівня глюкози в крові. Більшість випадків легко переносились.
Гіпоглікемія у хворих на цукровий діабет 2 типу
У клінічному досліджені були повідомлення про випадки тяжкої гіпоглікемії у 0,7 % пацієнтів з надмірною масою тіла чи ожирінням, які страждали на цукровий діабет 2 типу й застосовували лікарський засіб Саксенда® у поєднанні з дієтою та фізичною активністю та які застосовували сульфонілсечовину. Також зафіксовано виникнення симптомів гіпоглікемії у 43,6 % пацієнтів, які застосовували лікарський засіб Саксенда®, та у 27,3 % пацієнтів, які отримували плацебо. Серед пацієнтів, які не застосовували сульфонілсечовину, було зафіксовано виникнення симптомів гіпоглікемії (визначаються концентрацією глюкози у плазмі крові ≤ 3,9 ммоль/л) у 15,7 % пацієнтів, які отримували лікарський засіб Саксенда®, та у 7,6 % пацієнтів, які отримували плацебо.
Гіпоглікемія у хворих на цукровий діабет 2 типу, які отримують інсулін
У процесі клінічного дослідження були повідомлення про випадки тяжкої гіпоглікемії (що потребує сторонньої допомоги) у 1,5 % пацієнтів з надмірною масою тіла чи ожирінням, які страждали на цукровий діабет 2 типу та застосовували інсулін та ліраглутид в дозі 3,0 мг/добу у поєднанні з дієтою та фізичною активністю і застосуванням до 2 пероральних протидіабетичних препаратів. В цьому дослідженні було зафіксовано виникнення симптоматичної гіпоглікемії (визначена як рівень глюкози в плазмі крові ≤ 3,9 ммоль/л, що супроводжується симптомами) у 47,2 % пацієнтів, які отримували ліраглутид у дозі 3,0 мг/добу, та у 51,8 % пацієнтів, які отримували плацебо. Серед пацієнтів, які застосовували сульфонілсечовину, були зафіксовані повідомлення про виникнення симптомів гіпоглікемії у 60,9 % пацієнтів, які отримували ліраглутид 3,0 мг/добу, та у 60,0 % пацієнтів, які отримували плацебо.
Розлади травної системи
Більшість випадків виникнення розладів травної системи були легкого або помірного ступеня тяжкості та не призводили до припинення терапії. Зазвичай реакції виникали протягом перших тижнів лікування і зменшувались протягом декількох днів або тижнів при продовженні лікування.
У пацієнтів віком від 65 років при застосуванні лікарського засобу Саксенда® частіше спостерігатися порушення з боку травної системи.
У пацієнтів з порушеннями функції нирок легкої або середньої тяжкості (кліренс креатиніну ≥ 30 мл/хв) при застосуванні лікарського засобу Саксенда® можуть частіше виникати порушення з боку травної системи.
Гостра ниркова недостатність
Зафіксовано випадки виникнення гострої ниркової недостатності у пацієнтів, які застосовували агоністи рецепторів ГПП-1. Більшість зареєстрованих випадків спостерігали у пацієнтів, які страждали на нудоту, блювання та діарею, що і призводило до втрати рідини (див. розділ «Особливості застосування»).
Алергічні реакції
Були повідомлення про кілька випадків виникнення анафілактичних реакцій, що супроводжувались такими симптомами як гіпотензія, підвищене серцебиття, напади задухи та набряки після застосування ліраглутиду. Анафілактичні реакції можуть бути небезпечними для життя. Тому якщо є підозра на виникнення анафілактичної реакції, слід припинити застосування ліраглутиду (див. розділ «Протипоказання»).
Реакції в місці ін’єкції
Повідомлялось про реакції в місці введення лікарського засобу Саксенда®. Ці реакції зазвичай були легкими, більшість із них зникали в процесі подальшого лікування.
Тахікардія
У процесі клінічних досліджень були повідомлення про випадки тахікардії у 0,6 % пацієнтів, які отримували лікарський засіб Саксенда®, та у 0,1 % пацієнтів, які отримували плацебо. Більшість випадків були легкого або помірного ступеня тяжкості. Випадки були поодинокими, більшість із них зникали в процесі подальшого лікування.
Амілоїдоз шкіри
Амілоїдоз шкіри може виникнути в місці ін'єкції (див. розділ «Спосіб застосування та дози»).
Діти
У ході клінічного дослідження за участю дітей віком від 12 років із ожирінням 125 пацієнтів приймали лікарський засіб Саксенда® впродовж 56 тижнів.
Загалом частота, тип і тяжкість небажаних реакцій у дітей ≥ 12 років з ожирінням були зіставними із такими у дорослих пацієнтів. Порівняно з дорослими пацієнтами у дітей від 12 років удвічі частіше спостерігалось блювання.
Відсоток пацієнтів, які повідомили принаймні про один епізод клінічно значущої гіпоглікемії, був вищим у групі застосування ліраглутиду (1,6 %), ніж у групі плацебо (0,8 %). Під час проведення дослідження не зареєстровано жодного епізоду тяжкої гіпоглікемії.
Повідомлення про небажані реакції та відсутність ефективності лікарського засобу
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їх законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням https://aisf.dec.gov.ua.
Термін придатності30 місяців.
Дату завершення терміну придатності зазначено на маркуванні шприц-ручки та картонній упаковці після слів «Придатн. до».
Після першого застосування – 1 місяць.
Умови зберіганняЗберігати в недоступному для дітей місці.
Зберігати в холодильнику (2–8 °С) подалі від морозильної камери.
Після першого застосування зберігати при температурі нижче 30 °С або в холодильнику
(2–8 °С). Не заморожувати.
Для запобігання дії світла зберігати шприц-ручку із закритим ковпачком.
Несумісність
Додавання до лікарського засобу Саксенда® будь-якої субстанції може призвести до деградації ліраглутиду. Оскільки дослідження сумісності не проводилися, цей лікарський засіб не можна застосовувати з іншими лікарськими засобами.
УпаковкаПопередньо заповнена багатодозова одноразова шприц-ручка, виготовлена з поліпропілену, поліацеталу, полікарбонату та акрилонітрилу бутадієну стиролу, містить картридж (скло типу I) разом із поршнем (бромбутил) та ламіновану гумову прокладку (бромбулит/поліізопрен).
Кожна шприц-ручка містить 3 мл розчину, що дає можливість ввести дози по 0,6 мг, 1,2 мг, 1,8 мг, 2,4 мг та 3,0 мг.
Упаковка містить 1, 3 або 5 попередньо заповнених шприц-ручок.
Категорія відпускуЗа рецептом.
ВиробникА/Т Ново Нордіск.
Місцезнаходження заявника/виробника та адреса місця провадження його діяльності.
Ново Аллє
2880, Багсваерд
Данія.
Увага! Інструкція до препарату на сайті має інформаційне значення. Перед застосуванням ознайомтесь з інструкцією виробника!
«Саксенда раствор для инъекций 6 мг/мл 3 мл картридж в шприц-ручке №3, Ново Нордиск» – это инновационное лекарственное средство от компании Ново Нордиск, разработанное для борьбы с ожирением и контроля веса. Активным веществом препарата является лираглутид, который является аналогом глюкагоноподобного пептида-1 (GLP-1), регулирующего аппетит и калорийность потребляемой пищи. "Саксенда" выпускается в виде раствора для инъекций в картриджах, вмонтированных в шприц-ручки и отпускается по рецепту врача.
Показания к применению
«Саксенда» предназначена для лечения ожирения у взрослых с индексом массы тела (ИМТ) 30 кг/м² и выше, а также для пациентов с ИМТ 27 кг/м² и выше, которые имеют состояние связанное с ожирением, такие как диабет 2 типа, артериальная гипертензия, дислипидемия. Препарат используется в комплексе с диетой и увеличением физической активности.
Противопоказания
Противопоказаниями к использованию «Саксенды» являются гиперчувствительность к лираглутиду или любому вспомогательному компоненту препарата, беременность, период кормления грудью, детский возраст до 12 лет.
Возможные побочные реакции
Побочные эффекты могут включать тошноту, рвоту, диарею, запор, головную боль, головокружение, повышенную усталость, диспепсіюсухість во рту, гастрит, желчнокаменную болезнь, реакции в местах инъекций, повышение уровня липазы. Менее распространенными являются аллергические реакции, увеличение сердцебиения, депрессия, гипогликемия, бессонница. При возникновении тяжелых или длительных побочных эффектов необходимо немедленно обратиться к врачу.
Способ применения и дозировка
Начальная доза составляет 0,6 мг в сутки. Для улучшения переносимости со стороны желудочно-кишечного тракта дозу следует увеличивать еженедельно на 0,6 мг до достижения суточной дозы 3,0 мг.
Детям в возрасте от 12 лет не требуется коррекция дозы. Препарат следует вводить подкожно, в переднюю часть брюшной стенки, на бедро или плечо, один раз в сутки, в любое удобное время, без обязательного приема пищи.
Наиболее распространенные проявления передозировки
При передозировке «Саксендой» могут усилиться побочные эффекты, в частности тошнота, рвота и гипогликемия. В случае передозировки нужно немедленно обратиться за медицинской помощью.
Условия хранения и срок годности
Препарат следует хранить в сухом, темном месте при температуре 2-8 градусов Цельсия. После первого применения держать при температуре не выше 30 °C или в холодильнике (2-8 °C). Не замораживать. Срок годности – 30 месяцев. Не использовать препарат после окончания срока годности, указанного на упаковке.
Лекарственное средство хранить в недоступном для детей и домашних любимцев месте!
Эта информация является кратким изложением электронной инструкции и предоставлена исключительно с ознакомительной целью. Перед приемом «Саксенда раствор для инъекций 6 мг/мл 3 мл картридж в шприц-ручке №3, Ново Нордиск» обязательно необходимо проконсультироваться с врачом и ознакомиться с официальной инструкцией от производителя, прилагаемой к упаковке. Данный препарат можно приобрести по приятной цене в сети аптек «Бажаємо здоров'я».
Помните, что самолечение может вредить здоровью.
Отказ от ответственности
Информация размещенная на сайте https://apteka.net.ua/ru носит, исключительно, информационный характер. Администрация сайта https://apteka.net.ua/ru не несет ответственности за возможные негативные последствия, которые могут возникнуть в результате ознакомления пользователя с информацией размещенной на сайте.
Услуги, продукты, информация и другие материалы на официальном сайте сети аптек «Бажаємо здоров’я» и на официальных страницах в социальных сетях размещены, исключительно, в информационных целях и не должны восприниматься как альтернатива консультации врача. Сеть аптек «Бажаємо здоров’я» не несет ответственности за какие-либо выводы, которые были установлены и приняты во внимание читателем самостоятельно на основании размещенной информации.
Установление диагноза и выбор методики лечения осуществляется только профильным врачом. Обязательно перед применением препарата проконсультируйтесь с врачом!
Помните, самолечение может нанести вред вашему здоровью!